- Некоторые интересные факты из биографии Дмитрия Менделеева
- Старые названия химических элементов системы Менделеева (ПСМ)
- Эфир в таблице Менделеева: нулевой элемент и его значение
- Что говорил сам Д. Менделеев по поводу Эфира
- Нулевая группа Таблицы Менделеева
- Эфир по-гречески и “Белый Свет” по-славянски
- Таблица Менделеева изданная в 1906 году
Таблица Менделеева, краеугольный камень современной химии, хранит немало тайн. Одна из самых интригующих – это история эфира, загадочного элемента, который когда-то занимал почетное место в периодической системе. Что же такое эфир, какую роль он играл в научных представлениях своего времени и почему исчез из таблицы Менделеева? В этой статье мы погрузимся в историю науки, исследуем теории эфира, рассмотрим эксперименты, которые поставили под сомнение его существование, и узнаем, как теория относительности Эйнштейна изменила наше понимание мира.
В Европе к сожалению не упоминают имя этого выдающегося ученого, там существуют свои претенденты на это научное открытие. Но мы будем разговаривать о факте изменения самой таблицы после смерти Дмитрия Ивановича, не уступающего по своему величию даже самому Леонардо да Винчи. Ведь труды по химии составляли всего 10% от общего вклада этого ученого в другие науки.
Некоторые интересные факты из биографии Дмитрия Менделеева
Но чтобы перейти к загадкам Таблицы Менделеева, нам необходимо пройтись кратко по биографии Дмитрия Ивановича Менделеева, она очень интересна и очень необычна как и все его научные открытия. Как и везде всех выдающихся людей, так и Менделеева, окутывают ряд надуманных событий и фальсификаций в его биографии, а так же научных открытий.

В быту часто Дмитрия Ивановича считают “отцом изобретения русской водки”, это не правда. Как и не правда что Менделеев увлечен изготовлением чемоданов на продажу, это он делал в свободное от науки время. А вот научных открытий у него были не то что десятки, а сотни, и различных сферах науки. А то что он был любителем воздухоплавания на воздушных шарах, так это да, и однажды он чуть не разбился на нем проводя какие-то изыскания по атмосферным потокам Земли. Менделеев издал очень много книг по химии, экономике, социологии, конструировал высокоточные приборы, разрабатывал таможенные тарифы. А самое главное – по его технологии изготавливался самый лучший на то время бездымный порох, который по своей нерадивости мы закупали у Америки под названием “порох Менделеева”.
Дмитрий Иванович Менделеев исследовал спиритизм и магию, возглавлял русскую метрологию. Выступал экспертом на судебных процессах о подделке денежных знаков. Сам себя Менделеев называл “волонтером нефтяного дела”, заложив основы нефтяной индустрии царской России.
Менделеев родился в 1834 году в Тобольске, столице Сибири. Губерния тогда простиралась от Уральских гор и до Тихого океана, это были неизведанные земли Великой Тартарии. Тобол (Тобольск) в те времена считался самым богатым городом на Земле, и это был город “особых людей”, вольных, сильных, авантюристов по натуре. К моменту рождения Дмитрия город стал терять свою былую мощь, он становится более провинциальным и простым. Люди начинают выезжать потихоньку в центр, что впоследствии сделает и сам Менделеев, вывезя в Подмосковье и всю свою родню.
Дед Дмитрия Ивановича был священником и обучал грамоте многих выдающихся людей, в том числе самого Алексея Аракчеева, впоследствии он стал великим российским государственным деятелем, военным министром, реформатором русской артиллерии.
Отец Менделеева родился с наследственной фамилией Соколов. Он как и его братья закончил Тверское духовное училище. После окончания училища отцу дают новую фамилию и он из Соколова становится Менделеевым, так как любил Менять для дела различные вещички среди студентов. Почему так, просто, в церковной традиции того времени, если несколько братьев становились священниками, то отцовскую фамилию мог наследовать только один из них, а остальные получали фамилии созвучные библейским персонажам. Вот почему так много у нас фамилий с еврейскими именными названиями. Однако отец не пошел по церковной линии, поступил в Петербургский педагогический институт на филологический факультет. Впоследствии он занимал должность директора Тобольской гимназии и был заведующим всех училищ Сибирской губернии.
Мать Менделеева родом из Сибири из рода купцов. В то время купцами в Сибири обычно были или староверы или старообрядцы. Мария была женщиной очень образованной, она закончила полный курс гимназии. После смерти родителей она как и ее братья берет в свои руки семейный бизнес. Вот и говорят некоторые, что в царской России женщины не получали достойного образования и им нельзя было вести какой либо бизнес. Может это касалось некоторых христианских течений, а так остального общества это не касалось. В подчинении у Марии была стекольная фабрика в какой-то деревне. Она всю жизнь занималась этим предприятием и оно было образцовым на то время. Мария за свою жизнь родила 17 детей и Дмитрий был последним ребенком в семье. Когда умер отец семейства, то большая семья жила за счет доходов этого завода.
Как уже мы писали глава семейства был заведующим всех училищ Сибири и у них в доме собирались часто большое общество из образованных людей: сказочник-писатель Петр Ершов, декабрист Муравьев, Фонвизин, Пущин и другие.
Дмитрий был не прилежным учеником, учился он не стабильно, много прогуливал уроков, не любил иностранные языки, особенно латынь. Его однажды оставили на второй год, он постоянно с кем-то дрался. Всем он говорил так: ” У меня сегодня ломит спину, пойду подерусь на Тобольский мост!”
В те времена в царской России существовал такой закон, что молодые люди могли поступать в высшие учебные заведения только по месту проживания. Поступать Менделеев мог только в Казанский университет. Но мать смогла устроить Дмитрия в Петербургский педагогический институт еще и за казенный счет. Там же в Петербурге Мария Менделеева заболела и через пару недель она умерла, а через некоторое время умирает и его младшая сестра. Это круто поменяло взгляд на жизнь у Менделеева.
Закончив институт Менделеев пишет свою первую работу “Исследование водных растворов по удельному весу”. Начинал свою карьеру Менделеев как и все – бедным преподавателем. Но добывать себе деньги какими-то другими ремеслами он не захотел и сел писать учебник по химии, труд был закончен через три месяца и он смог выиграть денежную премию имени Давыдовых. С этого момента он мог посвятить себя полностью науке.
В тридцать лет Менделеев становится штатным доцентом Петербургского университета. В то время он и написал диссертацию о 40* градусном стандарте русской водки. Это был труд написан по заказу таможни, Дмитрий Иванович сделал таблицы об объемах спирта при различном % содержании спирта и различных температурах воздуха. Русскую водку Менделеев не изобретал, он ее привел под общий торговый стандарт.
Второй миф на который Менделеев очень негативно реагировал, что ему Периодическая таблица однажды приснилась ночью. Он говорил, что над ней он думал лет двадцать. У него были “игровые” карты, но вместо “дам” и “вальтов” были нарисованы химические элементы с их характеристиками, он разлаживал различные “пасьянсы” из этих карт, и думал, думал и думал. И вот, 17 февраля 1869 года Дмитрий Иванович, в возрасте 35 лет, утром закрывается в своем кабинете, и до вечера не выходит из него. А к концу дня у него на столе разложен “пасьянс” из знаменитой “Периодической системы химических элементов”. В то время ученые еще не открыли что такое атом и что такое ядро.
Старые названия химических элементов системы Менделеева (ПСМ)
6 марта в научном журнале выходит статья , где впервые появляется на свет Периодическая система Менделеева. Человечество впервые видит что систематизирован тот хаос из которой состоит наша Вселенная.

Вот некоторые названия этих химических элементов:
- Водород – рождающий воду. В более старых научных книгах по химии вместо окончания “род” писали “твор”: углетвор, вододтвор.
- Кислород – рождающий кислую среду, различные кислотные среды.
- Углерод – рождающий уголь, то есть рождающий землю или почву. Вот так писалось древнее слово уголь – первая буква “одь”, ее образ “наследие”, произносится “еу”, получаем “еугълъ”, ъ – краткое “о”. Читаем – еуголо. “Гол”, голое или изначальное, на котором все произрастает.
- Азот – “азъ-от”. “Азъ” – первая буква, первый, “от” – 28 по счету буквица, она пишется как буква “т” над “w”. Полный образ – граница, с которой начинается жизнь. Это та часть нашего земного воздуха, без которого не возможно возникновение “род”, рождения всего.
- Хлор – более его позднее название – Солерод.
- Железо – “ж”, живот, жизнь. “е” – бытие, где мы живем. “лезо”- лезвие, то чем можно отрезать, раньше этим словом называли край листа камыша, им разделывали мясо животных. Железо, вещество из которого можно изготавливать предметы и отрезать “части жизни”. Чугун – раньше считался отходом производства при выплавки стали. Чистое железо в печи “домница” получить тяжело, надо иметь температуру 1600*С, чугун получается при температуре 1200*С. Этот отход производства называли “свинным материалом” или “чушка” (старинное название свиньи, чухается, трется об стволы деревьев), так за этим материалом закрепилось слово “чугун”. Сталь – произошло от слова “стать”, становится, материал который стал (появился) из чугуна, чушки.
- Кобальт – его название происходит от немецкого слова “домовой”, “гном”.
- Никель – название тоже происходит от немецкого слова “озорник”, “дух гор”.
- Медь – латинское слово “купрум” дано в честь острова Кипр, где было древнейшее месторождение меди. Русское название “медь” имеет общий корень с “пчелиным медом”, цвет практически один.
- Галлий – данное название дано в честь Франции, символом которой является “петух”.
- Мышьяк – русское название происходит от слова “мышь”, его химическими соединениями травили крыс и мышей. В Европе мышьяк – “арсеникум” пришел из древнегреческого языка и переводится как “мужской”.
- Селен – этот элемент свое имя получил в честь спутника Земли – Луна, по-гречески звучит Селена.
- Бром – с греческого данный элемент звучит как “вонючка”.
- Серебро – на праславянском писалось “сьребро” (се-ре-бо-ро) и похоже на слово “блестящий”. Греческое “аргурос” и латинское “аргентум” произошли от индоевропейского корня “ерго”, означающего “белый, блистающий”.
- Олово – название идет от древнего корня “ол”, в латинском языке это albus – что означает “белый”. Так что металл назван по своему цвету.
- Теллур – название происходит от латинского слова “теллус”, что обозначает нашу планету Земля.
- Вольфрам – с немецкого “волк пожирающий овцу”. При выплавке олова образовывал шлак, который поглащал олово.
- Платина – в переводе с испанского означает “серебришко”. Такое название ему дали испанские конкистадоры из-за ее тугоплавкости. До этого Старый Свет не знал что такое платина, а вот инки им пользовались с незапамятных времен.
- Золото – слово происходит от праславянского “золто” – желтый, золотистый.
- Ртуть – от праслав. “рьтоуть” – “катиться”.
- Свинец – славянское название похоже он взял от названия цвета неба “синева”. Латинское название “плюмбум” происходит от слова “водопроводчик”. В Древнем Риме из него делали водопроводные трубы.
Внимание: В этом разделе выложены не все переводы названий химических элементов Таблицы Менделеева.
Более подробный обзор химических элементов , откуда и кому дали то или иное название, напечатан в конце статьи. Есть некоторые интересные исторические данные.
Эфир в таблице Менделеева: нулевой элемент и его значение
Дмитрий Менделеев в своей таблице оставил клетки и предсказал характеристики химических элементов которые будут открыты в ближайшем будущем. Это были элементы с “тяжелыми” по энергетическим вибрациям кристаллических решетках. Ему было понятно, чем тяжелее химический элемент, тем менее стабильно его существование. То есть если взять за основу энергию, его постоянные колебательные движения, то получается чем более низкие колебательные движения, тем короче жизнь, та жизнь которая базируется на основе “главного” элемента какой-то субстанции.
А что же с элементами более “легкой” вибрацией чем Водород? Для таких элементов Менделеев отвел отдельную строку в левом верхнем углу своей таблицы под названием ЭФИР. После смерти Дмитрия Ивановича, примерно в 1910 году эту строку изъяли из Периодической системы Менделеева. Но слово “эфир” закрепилось в нашем языке благодаря другому изобретателю радио – Александру Попову, он дал старт выражению: “выход в эфир”, когда радиоволны распространялись в окружающей нашей среде.
Если вы считаете что таблица в сегодняшнем виде идеально и в ней все завершено, то вы ошибаетесь. В интернете есть Теория “заговора” вокруг таблицы Менделеева. Во первых, имя Дмитрий Иванович Менделеев стараются стереть из памяти человечества, и под его именем таблица во всех странах мира давно не пишется. Заговор этот связан с тем, что в первом варианте таблицы Менделеева верхний ряд, где “один” и “ноль” выглядел при жизни Менделеева немного по другому. Дмитрий Иванович полагал что есть некое неоткрытое вещество в нынешний момент, которое он назвал “эфир”, которое он помещал в основу всего Мироздания. И вот это вещество, которое может излучать собой бесконечную энергию в разных вариантах соединений и бесконечно выделять тепло, от этого вещества и нужно строить всю науку на Земле.
То есть Менделеев пытался создать науку обо всем сразу, определив основную субстанцию из которой все рождается. Как это похоже на былины и легенды наших предков во главе с Богом Родом. Но люди злой воли братья Нобели, Рокфеллеры, Ротшильды, Морганы и им подобные, все кто зарабатывал миллиарды на нефти, угле и других источниках энергии, поняли, что в случае открытия эфира, доходов им не видать. Если наука пойдет по пути, как предсказал Менделеев, никакой необходимости обогрева жилищ не надо и транспорт для перемещения не нужен, вся жизнь будет устроена по другому. Появится идеальное экологически чистое топливо, которое почти ничего не будет стоить человечеству.
Все изыскания по поводу существования эфира были запрещены в научной среде после 1910 года. Тайны таблицы Менделеева скрыты от человечества, их надо искать заново.
Что потеряло человечество от изменения таблицы Менделеева и отсутствия “нулевой группы”. Перед водородом существуют элементы с меньшим атомным весом, а в “нулевом ряду” есть предельный элемент с ничтожно малым атомным весом, не способным к химическим взаимодействиям и обладающий чрезвычайно быстрым собственным частичным газовым движением. Часто это напоминает “темную” материю, как сейчас предполагают физики, хотя об этом вряд ли знал Менделеев. Наши предки знали о круговороте веществ и энергии в природе. где “ма-ть”, материя превращается в обратное в “ть-ма”, антиматерия, или как их часто называют Миры Нави.
Что давала идея “мирового эфира” – перенос энергии на различные расстояния. Как сказал Дмитрий Иванович Менделеев: “Задачу тяготения и задачи всей энергетики нельзя представлять реально решенным без реального понимания эфира, как мировой среды, передающей энергию на расстояния. Именно игнорирование эфира приводит к ложному, но прибыльному выводу, что добывать энергию можно лишь разрушая вещество. Отсюда и ложный тезис об отсутствии у нынешней топливной энергетики реальной альтернативы.”
Что говорил сам Д. Менделеев по поводу Эфира
Выдержка из статьи Д. Менделеева “Попытка химическаго пониманiя мiрового эфира”:
“Представляя эфир газом, обладающим указанными признаками и относящимся к нулевой группе, я стремлюсь прежде всего извлечь из периодического закона то, что он может дать, реально объяснить вещественность и общее распространение эфирного вещества повсюду в природе и его способность все вещества не только газо- или парообразныя, но и твердыя и жидкия, так как атомы наиболее легких элементов, из которых состоят наши обычныя вещества, все же в миллионы раз тяжелее эфирных и, как надо думать, не изменят сильно своих отношений от присутствия столь легких атомов, каковы атомы “х” или эфирные.
Понятно само собою, что вопросов является затем и у меня самого целое множество, что на большую часть из них мне кажется невозможным отвечать, и что в изложении своей попытки я не думать ни понимать их, ни пытаться отвечать на те из них, которые мне кажутся разрешимыми. Писал не для этого свою “попытку”, а только для того, что бы высказаться в таком вопросе, о котором многие знают, думают, и о котором надо же начать говорить.”

Нулевая группа Таблицы Менделеева
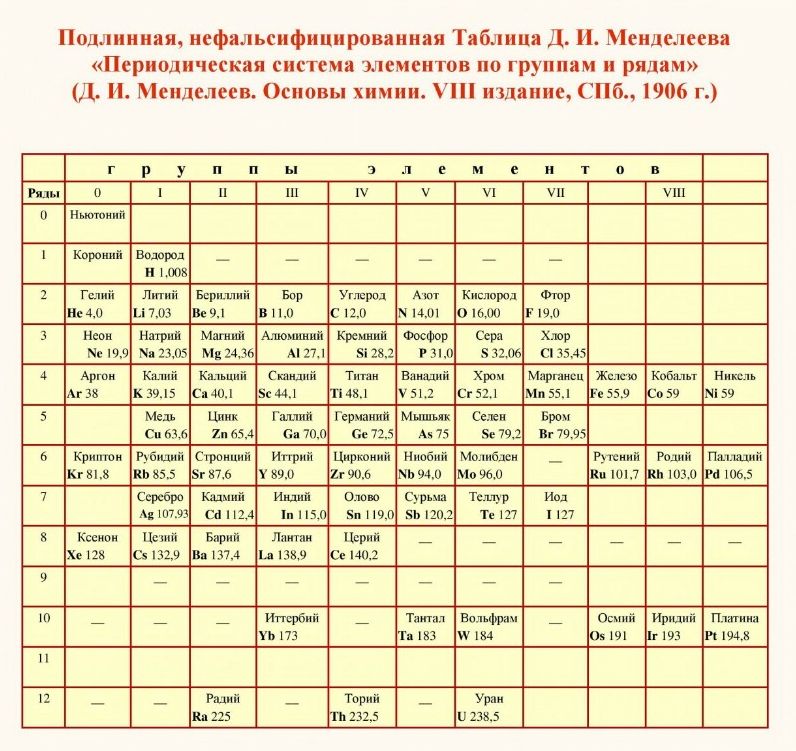
Сейчас официальная таблица химических элементов Менделеева ничего общего не имеет с той таблицей которую издал сам автор. Менделеев в работе под названием “Попытка химического понимания мирового эфира” привел несколько иную таблицу.
Последний раз в неискаженном виде настоящая Таблица Менделеева увидела свет в 1906 году в учебнике “Основы химии”, 8 издание, С-Петербург.
Какие отличия мы видим. Нулевая группа перенесена в 8-ю, а элемент который легче водорода, с которой должна начинаться Периодическая таблица, исчезает. Дмитрий Иванович его условно назвал Ньютонием, так же его называли и эфиром.
Однако кто-то из “провидцев” ученых и архитекторов увековечил настоящую Таблицу Менделеева на стене Всероссийского научно-исследовательского института метрологии им. Д.И.Менделеева.
Памятник-таблица Периодической системы выполнен мозаикой под руководством профессора Академии художеств В.А.Фроловым. В основу памятника положена именно та таблица из учебника “Основы химии” от 1906 года. Элементы, открытые при жизни Д.И.Менделеева обозначены красным цветом. Элементы, открытые с 1907 по 1934 года, обозначены синим цветом.
Авторское название таблицы – Периодическая система элементов по группам и рядам.
Эфир по-гречески и “Белый Свет” по-славянски
Слово “эфир” имеет греческое происхождение. Это верхний слой неба в древнегреческой мифологии, место пребывания Богов. В средневековой натурфилософии, физике и алхимии это тончайшая пятая стихия.
В славянских сказках и былинах аналогичными функциями обладает Белый Свет.
По теории Эйнштейна наибольшей скоростью обладает световая волна. Однако в природе существуют скорости и побыстрее, например скалярные скорости. Скалярная волна состоит из двух накрадывающихся друг на друга компонентов, каждый из которых по-разному взаимодействует с материей. Один компонент – (положительное время), позитивная энергетическая волна – взаимодействует с отрицательно заряженными электронами. Другой – (отрицательное время), отрицательная энергетическая волна – взаимодействует с положительно заряженными протонами в ядре. Каждая биологическая клетка составлена из субатомных биопотенциалов. Эти биопотенциалы находятся в ядре атомов и могут формировать беспорядочные или неструктурированные паттерны скалярной энергии. Эти паттерны также образуют зеркальные подструктуры в вакууме.
Естественная скалярная энергия в изобилии пребывает вокруг нас. Наши системы находятся в постоянном течении, или потоке, поглощения или высвобождения этой энергии. Возможно увеличить этот поток или скорости обмена потока с внешней Вселенной.
Скалярная энергия поглощается клетками, что выражается в заряде или организации биопотенциалов. Это нечто, что не могут делать обычные поля. Обычные электромагнитные поля не снабжены организующим потенциалом; они могут влиять только на величину биопотенциалов. Как только клетки заряжаются, они могут высвобождать хранящийся потенциал в виде двух различных световых фотонов: один обычный фотон, другой – структурированный скалярный фотон, содержащий полный информационный паттерн клетки.
Если такой паттерн испускается из больной клетки, то паттерн болезни транслируется и передается всем клеткам тела. Ядро клетки может заряжаться как конденсатор. Когда ядро накапливает скалярную энергию, оно может неоднократно подвергаться циклу “заряд-разрядка”, обеспечивающему энергией и электричеством для разнообразных процессов на биологическом и небиологических уровнях.
Хорошо такие волны воспринимает ладонь руки человека, вмещающий тонкий резонансный детектор.
Как таковой эфир не признается современной наукой и современные ученые обходят это слово заменяя его “нулевой точкой”. Возбуждение “нулевой точки” это когда гигантское количество энергии идет от тока гравитационных волн, которые являются ” продольными волнами”. Они появляются от интерференции электромагнитных поперечных волн, когда они складываются в единое целое, возникает продольный поток скалярных волн. Этот скалярный поток возбуждает физический вакуум, то есть “нулевую точку” с мощнейшей энергией, при этом у этой “нулевой точки” нет массы, нет электрической энергии, но существует другая совершенная энергия, возбуждающая пространство и это пространство наполняется гигантской силой.
Если рассмотреть эти силы на примере планеты Земля, то гравитационное поле Земли зависит от массы по закону Ньютона. Но гравитационное поле Земли зависит также и от пьезоэлектрического эффекта, который находится минералах гранита, а именно в силициях алюминия расположенного в верхних слоях коры Земли. Тут много находится кристаллов кварцита и пьезоэлектрический постоянный ток всегда присутствует и он выбрасывается на поверхность скал. Выбрасывается он волнами и возникают на этом месте гравитационные потоки, которые гасятся, потому что среда Земли анизотропна. Базальты в своей структуре не имеют кварца и потому у них нет пьезоэлектрического эффекта. Слабые волны не создают гравитацию. Есть планеты с огромной массой, но гравитация на этих планетах мала. Получается, что когда на силовых потоках поставить изотропную преграду с искусственным гранитом у которого огромное количество кристаллов кварцита, то эта энергия собирается, стекает на пики вершин и поток силы устремляется ноосферу. И это есть та сила, которая пронизывает все мегалиты Земли. Когда все это работало, не было на Земле пустынь, шли равномерно везде дожди, люди управляли погодой по звездам, как клетки управляют нашим организмом. Все это делалось с помощью эфира и “белого света”.
Дополнительная информация к статье:
Таблица Менделеева изданная в 1906 году
Ряд 0.
Ряд 0. Группа 0. Ньютоний. Характеристик волнового элемента нет.
Комментарий: Этот ряд должен иметь энергетические колебательные вещества которые имеют зеркальное отражение веществ нашего материального мира. Против Водорода стоит энергетическая волна меньше Водорода и его название указано как Короний. Те силы что удерживают позицию Водорода в данном лекале Природы.
Ряд 1.
0. Ряд 1. Группа 0. Короний. Характеристик волнового элемента нет.
1. Ряд 1. Группа 1. Водород Н. Атомная масса 1,008. Вещество с которого начался наш Материальный или Явный Мир. Он в системе Рода породил наш Земной мир соединяясь с другими элементами. На Земле этот газ предпочитает находится в в двухатомном состоянии Н2. Воду Водород родил или сотворил в паре с кислотой Кислородом. Взрывоопасен.
Комментарий: Данный ряд имеет промежуточные химические вещества похожие на Водород, в промежутке удельной атомной массы Гелия 4,0. Распространенный на земле химический элемент это Дейтерий Н2, есть еще два изотопа: Протий Н1 и Тритий Н3, он радиоактивен. Водород занимает три единицы атомного веса. Протий не содержит нейтронов и состоит только из одного протона. Из целого и единого имеет 2 атома соединенного воедино.
Ряд 2.
2. Ряд 2. Группа 0. Гелий Не. Атомная масса 4,0. Занимает второе место по распространённости во Вселенной. Одноатомный газ без цвета, вкуса и запаха. Электронов в оболочке 2. Имеет ярко-желтый спектр в солнечном свете. Ядра гелия сопутствуют альфа-частицам радиоактивных элементов урана и тория.
Комментарий: Гелий выделяет собой тонкоматериальную структуру как Свет. Он противоположен такому элементу как Водород и является результатом взрыва. Гелий обладает наибольшей возможностью передачи тепла в самой материи в результате конвекционных токов, при этом он течет в пространстве без сопротивления. Во Вселенной весь новый гелий образуется в результате термоядерного синтеза в недрах звезд. Если водород вышел из целого и имеет в своей массе 2 как Н2, то масса гелия 4, в два раза больше.
Гелий можно выделить и обнаружить в газовых месторождениях Земли.
3. Ряд 2. Группа 1. Литий Li. Атомная масса 7,03. Очень легкий мягкий щелочной металл серебристо- белого цвета. Вначале назывался “литион”, что с греческого обозначает камень. Имеет координационное число 8. Плотность лития в два раза меньше плотности воды. Кобальт лития очень энергоемкий химический элемент.
4. Ряд 2. Группа 2. Бериллий Ве. Атомная масса 9,1. Это относительно твердый щелочноземельный металл светло-серого цвета. Чрезвычайно токсичен. У него кристаллическая решетка простого вещества. Название “берилл” получил от города Веллуру, который находится в Южной Индии. Вначале его называли по-гречески “глиций”, что означало сладкий.
Во Вселенной бериллий – относительно редкий элемент, потому что он не образуется в результате ядерных реакций в недрах звезд, он образуется при взрыве сверхновых, в результате чего более тяжелые ядра расщепляются на более легкие потоками быстрых частиц.
5. Ряд 2. Группа 3. Бор В. Атомная масса 11,0. Это бесцветный серый или красный кристаллический, либо темный аморфный полуметалл. У него ромбоэдрическая решетка. Название произошло от арабского слова “бурак” (персидское), которое использовалось для обозначения буры. Почти во всех минералах бор связан с кислородом. Элементарный бор в природе не встречается. Чрезвычайно твердое вещество, уступает по твердости только алмазу.
Все изотопы бора возникли в межзвездном газе в результате расщепления тяжелых ядер космическими лучами при взрывах сверхновых звезд.
По многим физическим и химическим свойствам полуметалл бор напоминает кремний.
6. Ряд 2. Группа 4. Углерод С. Атомная масса 12,0. Кристаллическая решетка простого вещества. В окружающем нас мире встречаются изотопы: 12С и 13С являются стабильными, в то время 14С радиоактивный (его полураспад составляет 5730 лет и его использую для определения датировки в археологии).
Способность углерода образовывать углеродные цепочки порождает огромный класс соединений на основе углерода, называемых органическими, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия.
Углерод в виде древесного угля издревле применялся для выплавки металлов. Самые известные аллотропные модификации углерода – это алмаз и графит, они состоят из чистого углерода.
В древности наши предки углерод называли углетвор. В организм человека углерод поступает в виде пищи, это составляет 300 гр. в сутки. Общее содержание углерода в организме человека достигает около 21%. Углерод составляет 2/3 массы мышц и 1/ массы костной ткани. Выводится углерод из организма преимущественно с выдохом (углекислый газ) и мочой (мочевина).
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
7. Ряд 2. Группа 5. Азот N. Атомная масса 14,01. Как простое вещество азот – двухатомный газ без цвета вкуса и запаха. Один из самых распространённых элементов на Земле. Структура решетки – кубическая.
Азот основной компонент воздуха: 78%. Жидкий азот – хладагент. Азот – один из основных элементов, входящий в состав белков и нуклеиновых кислот.
Свое название “азот” берет от др.греческого “безжизненный”. До этого его называли “испорченный воздух”. Азот не поддерживает ни горение, ни дыхание. Само слово “азот” в русском говоре означает: “Аз”-первая буква, первичный; “от”-граница, начало отсчета, с древности употреблялось для обозначения “первичной материи металлов”. Алхимики считали “азот” “альфой и омегой” всего сущего. Слово алхимики составили из начальных и конечных букв трех языков,- латинского, греческого и древнееврейского: а, альфа, алеф и зет, омега, тав – АААZOT.
Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на многих планетах и спутниках солнечной системы, и других космических объектах. Азот – четвертый по распространённости элемент Солнечной системы, после водорода, гелия и кислорода.
Азот является химическим элементом необходимым для существования животных и растений, он входит в состав белков (!6%-18% по массе), аминокислот, нуклеопротеидов, хлорофилла, гемоглобина и др.
8. Ряд 2. Группа 6. Кислород О. Атомная масса 16,00. Кислород – химически активный неметалл, является самым легким элементом из группы халькогенов. Структура решетки: моноклинная. Как нормальное вещество (при нормальных условиях) кислород – газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов (формула О2).
При низких температурах имеет светло-голубой цвет, как и наша планета Земля.
Существуют и другие аллотропные формы кислорода, например, озон, со специфическим запахом, молекула которого состоит из трех атомов (формула О3). Озон образует озоновый слой в стратосфере.
В древние времена кислород называли “огненным воздухом”. В начале 19 века кислород именовался “кислотвором”. Своим названием в русском языке до какой-то степени обязан М.В. Ломоносову. Основу названия химического элемента дало слово “кислота”. Таким образом слово “кислород”, в свою очередь, явилось калькой термина “оксиген” (др.греческий – “кислый” и “рождаю”), который переводится как “порождающий кислоту”.
Кислород – самый распространённый в земной коре элемент. На его долю (в составе различных соединений, главным образом силикатов) приходится около 47% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода – 85,82% (по массе). В атмосфере содержание свободного кислорода составляет 21%.
Историческая справка 1: До появления первых фотосинтезирующих микробов в Архее (3,5 млрд. лет назад) в атмосфере практически кислорода не было. Свободный кислород в больших количествах начал появляться в Палеопротерозое (3-2,5 млрд. лет назад). Первый миллиард лет кислород практически поглощался растворенным в океане железом. 1,7 млрд. лет назад кислород достиг 10% от нынешнего уровня. Вместо анаэробным организмам пришли на смену аэробные организмы.
С начала Кембрия (540 млн. лет назад) содержание кислорода колебалось от 15% до 30% от объема. К концу Каменноугольного периода (300 млн. лет назад) уровень кислорода достиг максимума – 35%, который способствовал большому размеру насекомых и земноводных.
Историческая справка 2. Горные породы. 1.(3.85 – 2,45 млрд. лет. назад) – кислород О2 не производился, 2.(2,45 – 1,85 млрд. лет. назад) кислород О2 производился, но поглощался океаном и породами морского дна. 3.(1,85 – 0,85 млрд. лет. назад) – кислород О2 кислород выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя. 4.(0,85 – 0,54 млрд. лет назад) – все горные породы на суше окислены, начинается накопление кислорода О2 в атмосфере. 5.(0,54 млрд. лет назад – по настоящее время) – современный период, содержание О2 в атмосфере стабилизировалось.
Справка 1: Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60% кислорода от используемого живыми существами расходуется на процессы гниения и разложения. Так же 80% кислорода производимое лесами уходит на гниение и разложение растительности лесов.
Деятельность человека очень мало влияет на количество кислорода в атмосфере. Чтобы восстановить уровень кислорода в атмосфере необходимо около 2000 лет фотосинтеза растительности.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет 25%, по массе – 65%.
Комментарий: Природа с помощью кислорода не только поддерживает жизнь на Земле, но и убирает отжившее после смерти. Кислород горюч, но при правильном управлении, тихое горение (гниение) всю материю возвращает в исходное состояние.
Длительное вдыхание чистого кислорода может иметь опасные последствия для организма. Безопасно длительно дышать при обычном давлении смесями, содержащими до 60% кислорода, вдыхая и выдыхая через нос, поскольку зубная эмаль и верхние дыхательные пути особенно страдают от контакта с чистым кислородом.
9. Ряд 2. Группа 7. Фтор F. Атомная масса 19,00. Фтор является самым химически активным неметаллом и сильнейшим окислителем. Фтор относится к группе галогенов и является самым легким элементом из этой группы. Структура решетки – моноклинная. Как простое вещество (при нормальных условиях) фтор – это двухатомный газ (формула – F2) бледно-желтого цвета с резким запахом, напоминающий озон или хлор. Чрезвычайно токсичен. Обладает исключительно высокой коррозионной активностью.
В древности фтор назывался “флюор” от названия плавикового шпата “флюорит”. Название “фтор” с греческого языка обозначает “разрушительный”.
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (СаF2), содержащий по массе 51,3% кальций и 48,7% фтор. Из растений относительно богаты фтором чечевица и лук. В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Фтор является самым электроотрицательным элементом. Контакт фтора с водородом приводит к воспламенению и взрыву. Фтор “судорожный газ”.
Фтор является жизненно необходимым для организма элементом. Основным источником поступления фтора является питьевая вода. В организме человека преобладающая концентрация фтора содержится в эмали зубов и в костях скелета. При недостаточном потреблении воды у человека могут развиваться различные заболевания зубов. Избыток то же приводит к отрицательным последствиям.
Ряд 3.
10. Ряд 3. Группа 0. Неон Ne. Атомная масса 19,9. Неон – пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Простое вещество неон – это инертный одноатомный газ без цвета и запаха. Структура решетки: кубическая гранецентрированная.
Название происходит от греческого слова “новый”.
Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в атмосферах планет-гигантов: Юпитера, Сатурна, Урана, Нептуна. Из всех стабильных элементов второго периода неон – один из самых малораспространённых на Земле, наибольшая концентрация неона наблюдается в атмосфере.
Инертные газы обладают более высокой электропроводностью, при прохождении через них электрического тока светятся, неон – оранжево-красным светом. Неон используется так же в дыхательных смесях.
11. Ряд 3. Группа 1. Натрий Na. Атомная масса 23,05. В виде простого вещества натрий – это очень легкий, мягкий, химически активный щелочной металл серебристо-белого цвета. Структура решетки: кубическая объёмно-центрированная.
На внешнем энергетическом уровне натрий имеет один электрон, который он легко отдает, превращаясь в положительно заряженный катион. В свободном виде в природе натрий не встречается. Натрий – шестой по распространенности элемент в земной коре, он находится в составе многочисленных минералов, включая полевые шпаты, содалит и каменную соль.
Историческая справка: Соединения натрия известны и использовались с давних времен. Сода (натрон) встречается в природе в водах натронных озер в Египте. Природную соду древние египтяне использовали в смеси с маслом и служило моющим средством. А так же соду использовали для бальзамирования, отбеливания холста, варке пищи и изготовления красок.
Название “натрий” происходит от латинского слова, которое было заимствовано из среднеегипетского языка (ntr), где оно означало среди прочего: “сода”, “едкий натр”.
Натрий – серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий рез натрия блестит. Электропроводность и теплопроводность натрия довольно высоки. Щелочной металл, на воздухе легко окисляется до оксида натрия.
Натрий относится к макроэлементам и входит в состав всех живых организмов. В высших организмах натрий находится большей частью в межклеточной жидкости . Совместно с калием натрий выполняет следующие функции:
– создание условий для возникновения мембранного потенциала и мышечных сокращений.
– поддержание осмотической концентрации крови.
– поддержание кислотно-щелочного баланса.
– нормализация водного баланса.
– обеспечение мембранного транспорта.
– активизация многих энзимов.
Основным поставщиком натрия в организм является поваренная соль.
12. Ряд 3. Группа 2. Магний Mg. Атомная масса 24,36. Простое вещество магний – легкий, ковкий щелочноземельный металл серебристо-белого цвета. Структура решетки гексагональная.
Латинское название элемента происходит от названия древнего города Магнезия в Малой Азии, в окрестностях которого имеются залежи минерала магнезита.
Магний – один из самых распространенных элементов земной коры. Большое количество магния находится в морской воде в виде раствора солей. Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озер.
Магний необходим на всех этапах синтеза белка. Он участвует в поддержании нормальной функции нервной системы и мышцы сердца. Оказывает сосудорасширяющее действие, стимулирует желчеотделение, повышает двигательную активность кишечника, что способствует выведению из организма холестерина. Более всего магния содержится в пшеничных отрубях, тыквенных семечках, какао-порошке много его в кунжуте и орехах.
13. Ряд 3. Группа 3. Алюминий Al. Атомная масса 27,1. Невероятно, но факт: алюминий самый распространенный металл на Земле, на него приходится более 8% всей массы земной коры., и это третий по распространённости химический элемент на нашей планете после кислорода и кремния. Структура решетки: кубическая гранецентрированная.
Простое вещество алюминий – это легкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счет быстрого образования прочных оксидных пленок, защищающих поверхность от дальнейшего взаимодействия. Относится к группе легких металлов.
Название элемента образовалось от латинского слова alumen – квасцы. В России алюминий называли “серебром из глины” или, сокращенно “глинием”. Двойная соль алюминия и калия – квасцы, известны и использовались с глубокой древности.
Историческая справка: Первый завод по производству алюминия был построен в 1885 году в немецком городе Гмелингеме. Он работал по технологии предложенной Николаем Бекетовым. За пять лет работы на этом заводе было получено 58 тонн алюминия, на то время это было четверть всего произведенного “легкого металла”.
Несмотря на широкую распространенность в природе, не известно ни одно живое существо, использующее алюминий в метаболизме – это “мертвый металл”.
14. Ряд 3. Группа 4. Кремний Si. Атомная масса 28,2. Простое вещество кремний представляется в различных модификациях. В аморфной форме – это коричневый порошок, в кристаллической – темно- серый, слегка блестящий полуметалл, являющийся вторым по распространенности химическим элементом в земной коре после кислорода. Имеет очень важное значение в современной электронике. Структура решетки: кубическая алмазная.
В 1823 году был получен чистый элементарный кремний. Новому элементу было дано название “сицилий” ( от лат. silex – кремень). Русское название ” кремний” существует с 1834 года.
В земной коре кремний встречается только в связанном виде, чаще всего в виде кремнезема. Основные минералы и горные породы, образуемые диоксидом кремния, – это песок (речной и кварцевый), кварц и кварциты, кремень и полевые шпаты. Вторую по распространенности в природе группу соединений кремния составляют силикаты и алюмосиликаты. Есть единичные факты нахождения чистого кремния в самородном виде.
Свободный кремний получается при прокаливании мелкого белого песка (диоксида кремния) с магнием.
Для некоторых организмов кремний является важным биогенным элементом. Он входит в состав опорных образований у растений и скелетных – у животных. У позвоночных накопление кремния происходит в относительно больших количествах в волосах и перьях. Кремний имеется в мышечной ткани человека, костной ткани, крови. С пищей в организм человека ежедневно поступает до 1 г кремния.
15. Ряд 3. Группа 5. Фосфор Р. Атомная масса 32,0. Фосфор – один из распространенных элементов земной коры: его содержание составляет 0,08-0,09% ее массы. Концентрация в морской воде 0,07 мг/л. Структура решетки: кубическая, объёмно-центрированная.
В свободном состоянии фосфор не встречается в природе из-за своей высокой химической активности. Образует около 190 минералов, важнейшим из которых являются апатит и фосфорит.
Фосфор входит в состав важнейших биологических соединений – фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Историческая справка: Название веществу дал алхимик Бранд, он хотел получить золото из собственной мочи, потому что моча имеет золотистый цвет. В результате нескольких кипячений получались крупицы белого высокопробного вещества, которое очень ярко горело и к тому же ярко мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. “чудотворный носитель света”. Открытие фосфора Брандом в 1669 году стало первым открытием нового элемента со времен античности.
Фосфор бывает четырех видов: белый, желтый, красный и черный. Широко применяется в производстве красный фосфор так как он менее токсичен и ядовит по сравнению с другими. Красный фосфор применяют при изготовлении спичек. Белый фосфор очень ядовит, попадая на кожу, дает тяжелые ожоги.
16. Ряд 3. Группа 6. Сера S. Атомная масса 32,06. Простое вещество сера – это светло-желтый порошкообразный неметалл. В водородных и кислородных соединениях находится в составе различных ионов, образуя многие кислоты и соли. Практически не растворима в воде. Многие серосодержащие соли так же малорастворимые в воде. Кристаллическая решетка: орторомбическая.
Историческая справка: Название “сера (раньше “е” писали через “ять”) существовало издревле, обозначало оно вообще “горючее вещество”, “жир”. Этимология этого слова не выяснено до сих пор, так как слово дошло до нас в искаженном виде. Этот элемент использовался людьми задолго до нашей эры.
Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных Богов.
Очень давно сера стала применяться в составе различных горючих смесей для военных целей. С ведением пороха в Европе началось развитие добычи природной серы из пиритов.
Сера является шестнадцатым по химической распространенности элементом в земной коре. Сера – шестой элемент по содержанию в природных водах и обуславливает “постоянную” жесткость пресной воды.
Сера – жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
17. Ряд 3. Группа 7. Хлор Cl. Атомная масса 35,45. Простое вещество хлор – ядовитый удушающий двухатомный газ желтовато-зеленого цвета, тяжелее воздуха, с резким запахом и сладковатым “металлическим” вкусом. Структура решетки: орторомбическая. Хлор имеет отбеливающие свойства. Чистый хлор удалось получить Г.Дэви посредством электролиза, разложив поваренную соль на натрий и хлор. Он назвал это вещество “хлорин”. Долгое время у нас это вещество называлось “солерод”. В земной коре хлор – самый распространенный галоген. Хлор очень активен – он непосредственно соединяется почти со всеми элементами периодической системы.
В чистом виде хлор в природе не существует. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе и крови) и играет важную роль в регуляции осмотических процессов, а так же в процессах, связанных с работой нервных клеток.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов, у него нет свободных носителей заряда. Скорость звука в хлоре в полтора раза меньше, чем в воздухе.
Ряд 4.
18. Ряд 4. Группа 0. Аргон Ar. Атомная масса 38,0. Простое вещество аргон – инертный одноатомный газ без цвета, вкуса и запаха. Является третьим по распространенности химическим элементом в воздухе земной атмосферы – 0,93%. Структура решетки: кубическая гранецентрированная. В каждом кубическом метре воздуха присутствует 15 г. открытого газа аргон.
По предложению нобелевских лауреатов Релей и Рамзай открывших новое вещество, новому газу дали имя “Аргон”, что по-гречески означает – ленивый, медленный, то есть неактивный. Это название подчеркивало важнейшее свойство элемента – его химическую неактивность.
Содержание аргона в Мировой Материи мало и оценивается в 0,02% по массе. Аргон вместе с неоном наблюдается на некоторых звездах и в планетных туманностях. В целом его в космосе больше чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Аргон не играет заметной биологической роли. Все инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. У спортсменов этот газ является допингом.
19. Ряд 4. Группа 1. Калий К. Атомная масса 39,15. Простое вещество калий – мягкий щелочной металл серебристо-белого цвета. Структура решетки: кубическая объемно-центрированная.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а так же во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щелочь. Во многих свойствах калий очень близок к натрию, но с точки зрения биологической функции и использования клетками живых организмов они антагонистичны.
Историческая справка: Соединения калия используются с древнейших времен. Так, производство поташа (который применялся как моющее вещество) существовал уже в 11 веке. Золу образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щелок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия содержал сульфат калия и хлорид калия.
Историческая справка: Калий открыл английский ученый Дэви и назвал его “потасий”, это название до сих пор используют во многих европейских языках. Немецкий химик Л.В.Гильберт назвал его kalium, от арабского слова аль-кали, то есть поташ.
Калий 7-й по распространенности металл в земной коре. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д.
Калий – важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве, растения развиваются плохо, уменьшается урожай, поэтому 90% добываемых солей калия используются в качестве удобрений.
Калий в качестве катиона наряду с катионами натрия является базовым элементом так называемого натрий-калиевого насоса клеточной мембраны, который играет важную роль в проведении нервных импульсов.
20. Ряд 4. Группа 2. Кальций Са. Атомная масса 40,1. Простое вещество кальций – это умеренно твердый, очень легкий химически активный щелочноземельный металл серебристо-белого цвета. Кальций относится к числу жизненно важных элементов для живых организмов. Структура решетки: кубическая гранецентрированная.
Историческая справка: Название происходит от лат. calcis – “известь”, мягкий камень. Соединения кальция – известняк, мрамор, гипс, а так же известь – продукт обжига известняка применялись в строительном деле уже несколько тысячелетий назад.
Из-за высокой химической активности кальций в свободном виде в природе не встречается. Кальций занимает 5-е место по распространенности после кислорода, кремния, алюминия и железа.
Кальций – распространенный микроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая часть его находится в скелете и зубах..
21. Ряд 4. Группа 3. Скандий Sc. Атомная масса 44,1. Легкий переходный редкоземельный металл серебристого цвета с характерным желтым отливом. Существует в двух кристаллических модификациях: с гексагональной решеткой типа магния и с кубической объёмно-центрированной решеткой. Скандий – моно изотопный элемент, в природе встречается только один стабильный изотоп скандий-45.
Скандий является рассеянным элементом и входит в состав многих минералов, наприме, портвейтид стерриттит.
Элемент был предсказан Д.И.Менделеевым, как экабор в статье Датированной 29 ноября 1870 года, и открыт в 1879 году шведским химиком Ларсом Нильсоном в минералах эвксените и гадолините. Элемент был назван в честь Скандинавии.
Скандий не играет никакой биологической роли.
22. Ряд 4. Группа 4. Титан Ti. Атомная масса 48,1. Простое вещество титан в нормальных условиях – это легкий металл серебристо-белого цвета. Обладает высокой коррозионной стойкостью. Свое применение этот металл получил лишь в 1940 году. Металл получил свое название в честь Титанов, персонажей древнегреческой мифологии, детей Геи. Титан при нормальном давлении существует в двух кристаллических модификациях: низкотемпературный гексагональной плотноупакованной решеткой и высокотемпературной кубической объемно-центрированной упаковкой.
Титан находится на 9-м месте по распространенности в природе. В земной коре титан почти всегда четырехвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается.
Титан считается физиологически инертным, благодаря чему применяется в протезировании как металл, непосредственно контактирующий с тканями организма. Однако титановая пыль может быть канцерогенной. Как было сказано выше, титан применяется так же в стоматологии. Отличительная черта применения титана заключается не только в прочности, но и в способности самого металла сращиваться с костью, что делает возможность обеспечить квазимонолитность основы зуба.
23. Ряд 4. Группа 5. Ванадий V. Атомная масса 51,2. Простое вещество ванадий – пластичный металл серебристо-серого цвета, покрывается на воздухе красивой пленкой из оксидов ванадия, разные цвета которой обусловлены разной толщиной оксидного слоя. Образует кристаллы кубической сингонии (объемно-центрированная решетка).
Ванадий был открыт в 1801 году профессором минералогии из Мехико Андерсом Мануэлем Дель Рио в свинцовых рудах. Этот элемент образует соединения с красивой окраской, отсюда и название элемента, связанное с именем скандинавской богини любви и красоты Фрейи (др.-сканд. Vanadis дочь Ванов; Ванадис).
Ванадий является 20-м по распространённости элементом в земной коре. Он относится к рассеянным элементам в природе и в свободном виде не встречается. По химическим свойствам ванадий довольно инертен. Он имеет хорошую стойкость к коррозии, к действию морской воды, разбавленных растворов соляной, азотной и серной кислот и щелочей.
Ванадий и многие его соединения токсичны для человека в высоких концентрациях, при вдыхании поражает дыхательную систему. Ванадий и его соединения очень токсичны для водных организмов. Установлено, что ванадий может тормозить синтез жирных кислот, подавлять образование холестерина. При введении ванадия животным отмечается замедление роста, диарея и увеличение смертности.
24. Ряд 4. Группа 6. Хром Cr. Атомная масса 52,1. Простое вещество хром (при комнатной температуре) – это твердый переходный металл голубовато-белого цвета. Хром иногда относят к черным металлам. Структура решетки: кубическая объемно-центрированная.
Название “хром” произошло от греческого слова “цвет”, краска – из-за разнообразия окраски соединений этого вещества.
Хром был открыт во Франции в 1797 году химиком Л.Н.Вокленом. Он прокалил зеленый оксид хрома с углем, а сам оксид получил разложением “Сибирского красного свинца” добытого на Среднем Урале, в Березовском золоторудном месторождении, и впервые упомянутого в труде М.В.Ломоносова “Первые основания металлургии” (1763 год), как красная свинцовая руда. В 20-х годах 20 века разработан процесс электролитического покрытия железа хромом.
Хром появился во Вселенной из-за взрывов белых карликов и взрывов массивных звезд. Чистый хром – это хрупкий металл, при ударе молотком он разбивается. Также он является самым твердым из чистых металлов. Очень чистый хром достаточно хорошо поддается механической обработке.
Хром – один из биогенных элементов, он входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и в крови приводит к уменьшению скорости роста, увеличению холестерина в крови. В чистом виде хром довольно токсичен. Металлическая пыль хрома раздражает ткани легких.
25. Ряд4. Группа 7. Марганец Mn. Атомная масса 55,1. Простое вещество марганец – это твердый, но одновременно с этим, хрупкий переходный металл серебристо-белого цвета. относится к цветным металлам. Структура решетки: кубическая.
Один из основных минералов марганца – пиролюзит – был известен в древности как черная магнезия и использовался при варке стекла для его осветления. Русское слово марганец происходит от немецкого слова manganerz – марганцевая руда.
Марганец – 14-й элемент по распространённости на Земле, а после железа – второй тяжелый металл, содержащийся в земной коре. Марганец в виде ферромарганца применяется для раскисления стали при ее плавке, то есть для удаления из нее кислорода. В сочетании с другими легирующими металлами, сильно упрочняет сталь, делает ее твердой и сопротивляющейся износу и ударам.
Марганец принадлежит к пятой аналитической группе катионов. Марганец содержится в организмах всех растений и животных, хотя его содержание очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост , образование крови и функции половых желез. Особенно богаты марганцем листья свеклы и плоды дуарина, а также большое количество его находится в организмах рыжих муравьев. Избыточное накопление марганца в организме сказывается, в первую очередь на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также легкие, сердечно-сосудистую и гепатобилиарную системы, вызывает аллергический и мутагенный эффект.
26. Ряд 4. Группа 8. Железо Fe. Атомная масса 55,9. Простое вещество железо – это ковкий переходной металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро коррозирует на воздухе при высоких температурах или при высокой влажности. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Один из самых распространенных в земной коре металлов: второе место после алюминия.
Собственно железом обычно называют его сплавы с малым содержанием примесей. В природе железо редко встречается в чистом виде, чаще всего – в составе железно-никелевых метеоритов. Считается также, что железо составляет большую часть земного ядра, что проявляется в наличии магнитного поля Земли.
Железо как инструментальный материал известно с древнейших времен. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н.э. и относятся к древне шумерской и древнеегипетской цивилизациям. Изделия изготавливались из метеоритного материала. Первыми освоили метод выплавки железа хатты во 2-м тысячелетии до н.э. В самой глубокой древности железо ценилось дороже золота. В дальнейшем филистимляне научились делать более эффективные печи (в русском языке – домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до 1400*С, а чистое железо плавится при 1535*С. При этом образуется чугун с температурой плавления 1100-1200*С. Первоначально чугун считали вредным побочным продуктом – “свинское железо”, чушки, откуда собственно, и происходит слово чугун. Но потом обнаружили, что при повторной переплавке в печи с усиленном продувании воздуха чугун превращается в сталь хорошего качества.
Праславянское слово железо (“е” писалось через “ять”) является однокоренным словом “жалеза” и “желвак”, и имеет смысл как “округлый камень”, окатыш, блямба. Название природного карбоната железа (сидерита) происходит от лат. sidereus –звездный, действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Это официальная версия происхождения названия “железо”. Есть и другая версия.
Железо – “ж”, живот, жизнь. “е” – бытие, где мы живем. “лезо”- лезвие, то чем можно отрезать. “Лезом” в древние времена называли край листа камыша. Он очень твердый, им делали надрезы и разделывали мясо. Чистое железо в печи “домница” получить очень тяжело. Температуру 1600*С можно получить только при помощи мехов, которые пропускают в печь больше воздуха, вернее кислорода. Без дополнительно кислорода получается чугун. Раньше его считали отходом производства, пока не научились из чугуна получать сталь. Этот отход производства называли “свинным металлом” или “чушка”. Чушка – старинное название свиньи, животное, которое чухается, трется об стволы деревьев (чух-чух). Так за этим материалом закрепилось слово “чугун”. При повторной переплавке чугуна получается сталь. Слово сталь произошло от слова “стать”, становится. Чугун становится сталью.
Железо – типичный металл, в свободном состоянии – серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси в частности – углерод) повышают его твердость и хрупкость. Обладает ярко выраженными магнитными свойствами.
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). Основным внутриклеточным депо железа является глобулярный белковый комплекс – ферритин. Недостаток железа проявляется как болезнь организма: хлороз у растений и анемия у животных. Железо присутствует в ферменте “гем”, в частности в гемоглобине – важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. Именно он окрашивает кровь в красный цвет. В организме человека содержится около 3 – 4 граммов железа, из которых 3,5 мг находится в плазме крови. В организм животных и человека железо поступает с пищей. Наиболее богаты им печень и мясо, в меньшей степени яйца, бобовые (чечевица, фасоль), семена тыквы и кунжута, гречневая крупа, зелень – тимьян, петрушка, полевой салат, шпинат.
27. Ряд 4. Группа 8. Кобальт Со. Атомная масса 59. Простое вещество кобальт – это серебристо-белый, слегка желтоватый переходный металл с розоватым или синеватым отливом. Существует в двух кристаллических модификациях с гексагональной плотноупакованной решеткой и с кубической гранецентрированной решеткой.
Название “кобальт” происходит от немецкого слова kobold – домовой, гном. При обжиге содержащих мышьяк кобальтовых минералов выделяется летучий ядовитый оксид мышьяка. Руда, содержащая эти минералы, получила у горняков имя горного духа “кобольда”. Древние норвежцы приписывали отравления плавильщиков при переплавке серебра проделкам этого злого духа. В этом происхождение названия никеля (нем. Nickel – озорник, гном Никель).
Соединения кобальта известны человеку с глубокой древности. Первоначально кобальт нашел применение в качестве синего красителя при производстве декоративно-прикладного искусства. Синие кобальтовые стекла, эмали, краски находят в гробницах Вавилонии и Древнего Египта.
Специальные сплавы и стали – главное применение кобальта. Легирование стали кобальтом повышает ее твердость, износо- и жаростойкость. Из кобальтовых сталей создают обрабатывающий инструмент: сверла, резцы, и т.п.
Кобальт один из микроэлементов , жизненно важный организму. Он входит в состав витамина В12 (кобаламин) Кобальт задействован при кроветворении, функциях нервной системы и печени, ферментативных реакциях. При отсутствии кобальта развивается акобальтоз.
28. Ряд4. Группа 8. Никель Ni. Атомная масса 59. Простое вещество никель – это пластичный, ковкий, переходной металл серебристо-белого цвета. При обычных температурах на воздухе покрывается тонкой пленкой оксида. Химически малоактивен. Структура решетки: кубическая гранецентрированная.
Элемент получил свое название от имени духа гор (ср.нем. Nickel – озорник) немецкой мифологии, который “подбрасывал” искателям меди минерал красного цвета, похожий на медную руду (ныне известный как никелин).
Никель был открыт в 1751 году. Однако задолго до этого саксонские горняки хорошо знали руду, которая походила на медную и применялась в стекловарении для окраски стекол в зеленый цвет. Все попытки получить из этой руды медь оказались неудачными, в связи с чем руда получила название “купферникель”, что переводится как “медный упрямец” или “медный озорник”. Никкел – ругательное слово на языке горняков. Оно образовывалось из искаженного слова Nicolaus – родового слова, имевшего много значений, главным образом для характеристики двуличных людей (аналог русск. “б**дь”) и обозначало “озорной маленький дух”, “обманчивый бездельник”.
Никель характеризуется высокой коррозионной стойкостью – устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию – образованию на его поверхности плотной оксидной пленки, обладающей защитным действием.
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, особенно в перьях. Установлено, что поджелудочная железа очень богата никелем. При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность.
Никель – основная причина аллергии на металлы, контактирующие с кожей (часы, украшения, джинсовые заклепки). Во многих государствах есть запрет на использование никеля в медицинской технике.
Ряд 5.
29. Ряд 5. Группа 1. Медь Сu. Атомная масса 63,6. В виде простого вещества медь – это пластичный переходной металл золотисто-розового цвета (при отсутствии оксидной пленки). С давних пор широко используется человеком. Структура решетки: кубическая гранецентрированная.
Медь – один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Экспериментальные исследования С.А.Семенова с сотрудниками показали, что, несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий.
В древности медь применялась также в виде сплава с оловом – бронзы – для изготовления оружия и т.п. На смену каменному веку пришел медный, а затем и бронзовый. Это было соответственно происходило до 3000 лет до н.э., затем пришел железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Останки их находят на Урале (наиболее известное месторождение – Каргалы), в Закавказье, в Сибири, на Алтае, а также на территории Украины.
Латинское название меди Cuprum произошло от названия острова Кипр, где располагалось богатое месторождение. Второе латинское название aes Cyprium (санскрит. ayas, готск. aiz, нем. erz, англ. ore) означает руда или рудник.
Медь в средние века обозначалась алхимическим знаком “Венера” – “зеркало Венеры”. Это связано с тем, что богиня красоты Венера являлась богиней Кипра, и из меди делались зеркала. Известный персонаж сказов П.П.Бажова – хозяйка медной горы, покровительница добычи малахита и меди, чем- то напоминает богиню Венеру.
Русское слово медь встречается в древнейших русских литературных памятниках, но четкой этимологии происхождения этого слова у ученых нет.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
30. Ряд 5. Группа 2. Цинк Zn. Атомная масса 65,4. Простое вещество цинк при нормальных условиях – хрупкий переходной металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка). Структура решетки: гексагональная.
Сплав цинка с медью -латунь – был известен еще в Древней Греции, Древнем Египте, Индии и Китае. Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом был запатентован дистилляционный способ получения цинка.
Слово “цинк” впервые встречается в трудах Парацельса, который назвал этот металл латинским словом zincum или zinken в книге Liber Mineralium. Это слово, вероятно, восходит к немецкому слову Zinke, означающий “зубец” (кристаллиты металлического цинка похожи на иглы).
Известно 66 минералов цинка, наиболее распространенный минерал сфалерит, или цинковая обманка. Цинк – энергичный водный мигрант, особенно характерна его миграция в термальных водах вместе со свинцом. Из этих вод осаждаются сульфиды цинка, имеющие важное промышленное значение.
В организме взрослого человека содержится в среднем около 2 г. цинка в виде его соединений, которые концентрируются преимущественно в простате, мышцах, печени и поджелудочной железе. В 50 миллилитрах человеческой спермы содержится около 10 миллиграммов цинка.
Цинк:
– необходим для продукции спермы и мужских гормонов.
– необходим для метаболизма витамина Е
– важен для нормальной деятельности простаты
– участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
– необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы.
Рекомендуемая дневная норма цинка в рационе – 11мг для мужчин и 8 мг для женщин. В периоды активной половой жизни суточная потребность цинка у мужчин возрастает и составляет 30-70 мг. Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка – в устрицах, тыквенных и подсолнечных семечках, кунжуте, мясе, сыре, овсяной крупе, бобовых, шоколаде.
31. Ряд 5. Группа 3. Галлий Ga. Атомная масса 70,0. Простое вещество галлий – это мягкий хрупкий металл серебристо-белого цвета 9 по другим данным светло-серого) цвета с синеватым оттенком. Относится к группе тяжелых металлов. Структура решетки: орторомбическая.
Существование галлия было научно предсказано Д.И.Менделеевым. При создании периодической системы химических элементов в 1869 году он, основываясь на открытом им Периодическом законе, оставил вакантные места в третьей группе для неизвестных элементов – аналогов алюминия и кремния (эка-алюминий и эка-сицилий). Менделеев, основываясь на свойствах соседних, хорошо изученных элементов, достаточно точно описал не только важнейшие физические и химические свойства, но и метод открытия – спектроскопию. Открытие галлия и последовавшие вскоре открытия германия и скандия укрепило позиции Периодического закона.
Поль Эмиль Лекок де Буабодран назвал элемент в честь своей родины Франции, по ее латинскому названию – Галлия (Gallia). Существует недокументированная легенда, что в названии элемента его первооткрыватель неявно увековечил и свою фамилию (Lecoq). Латинское название элемента (Gallium) созвучно gallus – “петух” (лат.). Примечательно, что именно петух le coq (франц.) является символом Франции.
Химические свойства галлия близки к свойствам алюминия, но реакция металлического галлия, как правило, идут гораздо медленнее из-за меньшей химической активности.
Галлий не играет никакой биологической роли. Контакт галлия с кожей приводит к тому, что сверхмалые дисперсные частицы металла остаются на ней. Лучший способ убрать “серые пятна” с кожи – воспользоваться жидким мылом.
Галлий очень дорог, в 2005 году на мировом рынке тонна галлия стоила 1,2 млн. долларов США. Около 97% мирового производства галлия идет на различные полупроводниковые соединения.
32. Ряд 5. Группа 4. Германий Ge. Атомная масса 72,5. Простое вещество германий – это типичный полуметалл серо-белого цвета, с металлическим блеском. Подобно кремнию, является полупроводником. Структура решетки: Алмазная.
11 декабря 1870 года Д.И.Менделеев в своей статье предсказал существование элемента “эка- силиция”. В 1885 году немецкий химик Клеменс Винклер обнаружил новый химический элемент и дал ему название в честь родины – “германий”.
До конца 1930-х годов германий не использовался в промышленности. Во время второй мировой войны германий использовался в некоторых электронных устройствах, главным образом в диодах.
Германий незначительно содержится в земной коре, но все же его содержание больше, чем, например, сурьмы, серебра и висмута.
Германий обнаружен в животных и растительных организмах. Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Для животных германий мало токсичен.
33. Ряд 5. Группа 5. Мышьяк As. Атомная масса 75. Простое вещество мышьяк – это хрупкий полуметалл стального цвета с зеленоватым оттенком (в серой аллотропной модификации). Ядовит и является канцерогеном. Структура решетки: тригональная.
Мышьяк является одним из древнейших элементов, используемых человеком. Сульфиды мышьяка “арсеник” и “реальгар”, были знакомы римлянам и грекам, и они знали что эти вещества ядовиты.
Мышьяк является одним из элементов, встречающихся в природе в свободном виде. Его можно сравнительно легко выделить из соединений. Поэтому история не знает, кто первый получил мышьяк. В трудах Парацельса есть описание получения мышьяка в результате реакции “арсеника” с яичной скорлупой.
Название мышьяка в русском языке происходит от слова “мышь”, в связи с употреблением его соединений для истребления мышей и крыс. Греческое название и латинское arsenicum происходит от древнегреческого – “мужской”.
Известно около 200 мышьяков содержащих минералов. В небольших концентрациях часто сопутствует свинцовым, медным и серебряным рудам.
В западных странах мышьяк был известен преимущественно как сильный яд, в тоже время в традиционной китайской медицине он почти на протяжении двух тысяч лет использовался для лечения сифилиса и псориаза.
34. Ряд 5. Группа 6. Селен Se. Атомная масса 79,2. Простое вещество селен – это хрупкий блестящий на изломе неметалл серого цвета (данный цвет обусловлен устойчивой аллотропной модификацией, неустойчивые аллотропные модификации придают селену различные оттенки красного цвета). Структура решетки: гексагональная.
Элемент открыт Й.Я.Берцелиусом в 1817 году. Вот что он писал: “Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. Этот осадок, опробованный с помощью паяльной трубки, издавал слабый редечный запах и образовывал свинцовый королек. Согласно Клапроту, такой запах служит указанием на присутствие теллура. Ган заметил при этом, что на руднике в Фалуне, где собирается сера, необходимая для производства кислоты, также ощущается подобный запах, указывающий на присутствие теллура. Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило исследовать осадок. Приняв намерение отделить теллур, я не смог, однако, открыть в осадке никакого теллура. Тогда я собрал все, что образовывалось при получении серной кислоты путем сжигания фалюнской серы за несколько месяцев, и подверг полученный в большом количестве осадок обстоятельному исследованию. Я нашел, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого слова (Луна), так как теллур назван по имени Tellus – нашей планеты”.
В 1873 году Уиллоуби Смит обнаружил, что электрическое сопротивление серого селена зависит от освещенности. Электрический ток, проходящий через селен, пропорционален количеству света, падающего на его поверхность, -0 это свойство используется в различных измерителях освещенности.
Селен входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. В организме человека содержится 10-14 мг селена, большая часть его сконцентрирована в печени, почках, селезенке, сердце, яичках и семенных канатиках у мужчин. Селен присутствует в ядре клетки.
35. Ряд 5. Группа 7. Бром Br. Атомная масса 79,95. Простое вещество бром (при нормальных условиях) – это химически активный неметалл (химическая формула – Br2) – тяжелая едкая жидкость красно- бурого цвета с сильным неприятным “тяжелым” запахом, отдаленно напоминающим запах одновременно йода и хлора. Летуч и ядовит. Структура решетки: Орторомбическая.
Бром был открыт в 1825 году. Балар дал название открытому элементу название “мурид”, но комиссия Парижской Академии наук изменила название на “бром”, от греческого “бромос” – “вонь”. В России долгое время этот химический элемент шел под названием “вромий”.
В качестве исходного сырья для производства брома служат: морская вода; рассолы соляных озер; щелок калийных производств; подземные воды нефтяных и газовых месторождений.
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
Со времен Первой мировой войны бром используется для производства боевых отравляющих веществ.
Существует широко распространенная легенда, будто бы в армии, местах лишения свободы и психиатрических больницах добавляют соединения брома в еду для снижения полового влечения. Происхождение этого мифа доподлинно не известно.
Препараты брома имеют соленый вкус и оказывают седативный (успокаивающий) и снотворный эффект. Ни в коем случае не следует путать “аптечный бром” (водные растворы бромида калия или натрия), который применяют при расстройствах нервной системы, и элементарный бром, который является весьма токсичным веществом с раздражающим действием. Принимать элементарный бром внутрь ни в коем случае нельзя – это сильный яд.
Ряд 6.
36. Ряд 6. Группа 0. Криптон Kr. Атомная масса 83,8. Простое вещество криптон – тяжелый инертный одноатомный газ без цвета, вкуса и запаха. Структура решетки: Кубическая гранецентрированная.
В 1898 году Уильям Рамзай совместно со своим ассистентом Морисом Уильямом Траверсом выделил из жидкого воздуха, предварительно удалив кислород, азот и аргон, смесь, В которой спектральным методом были открыты два газа: криптон (от др-греч. “криптос” – “скрытый”, “секретный”) и ксенон (“чуждый”, “необычный”).
Получение криптона из воздуха является энергоемким процессом. Для получения единицы объема криптона ректификацией сжиженного воздуха нужно переработать более миллиона единиц объема воздуха.
Во Вселенной криптон встречается в более высоких пропорциях чем в литосфере Земли, сравнимых с литием, галлием и скандием. Соотношение криптона и водорода во Вселенной в основном постоянно. Из этого можно сделать вывод, что межзвездное вещество богато криптоном.
Воздействие криптона на живые организмы изучено плохо. Исследуются возможности его использования в водолазном деле в составе дыхательных смесей и при повышенном давлении как средство для анестезии. Большое количество вдыхаемого криптона при недостаточном количестве кислорода приводит к удушью. При вдыхании газовых смесей, содержащих криптон, при давлении более 3,5 атмосфер наблюдается наркотический эффект.
37. Ряд 6. Группа 1. Рубидий Rb. Атомная масса 85,5. Простое вещество рубидий – мягкий легкоплавкий щелочной металл серебристо-белого цвета. Структура решетки: Кубическая объёмно-центрированная.
В 1861 году немецкие ученые Бунзен и Кирхгоф, изучая с помощью спектрального анализа природные алюмосиликаты, обнаружили в них новый элемент, впоследствии названный рубидием по цвету наиболее сильных линий спектра. Название, которое происходит от латинского слова rubidus, что означает “насыщенно красный).
Важным применением рубидия являются исследования и разработки, главным образом в области химии и электроники. Рубидий обладает природной радиоактивностью 87Rb. По распространенности рубидий находится на 23-м месте, примерно как цинк, и более распространенным, чем медь. Однако в природе он находится в рассеянном состоянии. В космосе аномально высокое содержание рубидия находится у красных звезд сверхгигантов.
Гидроксид рубидия RbOH – одна из наиболее сильных щелочей, весьма агрессивен по отношению к стеклу и другим конструкционным и контейнерным материалам, а расплавленный гидроксид рубидия разрушает большинство металлов.
Большинство рубидия получают как побочный продукт при производстве лития из лепидолита.
Рубидий относится к элементам с недостаточно изученной биологической ролью. Он относится к микроэлементам. Обычно рубидий рассматривают совместно с цезием, поэтому их роль в организме человека изучается параллельно.
Рубидий постоянно присутствует в тканях растений и животных.. Наибольшее количество радиоактивного изотопа обнаружен у ряски.
38. Ряд 6. Группа 2. Стронций Sr. Атомная масса 87,6. Простое вещество стронций – это мягкий, ковкий, пластичный щелочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью, на воздухе быстро реагирует с влагой и кислородом, покрываясь желтой оксидной пленкой. Структура решетки: Кубическая гранецентрированная.
Новый элемент обнаружили в минерале стронцианиде, найденном в 1764 году в свинцовом руднике близ шотландской деревне Стронтиан, давшей в последствии название новому элементу. Выделен стронций в чистом виде сэром Хемфри Дэви в 1808 году.
В свободном виде стронций не встречается ввиду его высокой химической активности. Он входит в состав около 40 минералов.
Основные области применения стронция и его химических соединений – это радиоэлектронная промышленность, пиротехника, металлургия и пищевая промышленность. Изотоп с атомной массой 89, имеющий период полураспада 50,55 суток, применяется (в виде хлорида) в качестве противоопухолевого средства.
Стронций природный – составная часть микроорганизмов, растений и животных. Стронций является аналогом кальция, поэтому он наиболее эффективно откладывается в костной ткани. Стронций с большой скоростью накапливается в организме детей до 4-х летнего возраста, когда идет активное формирование костной ткани. Обмен стронция изменяется при некоторых заболеваниях органов пищеварения и сердечно-сосудистой системы.
39. Ряд 6. Группа 3. Иттрий Y. Атомная масса 89. Простое вещество иттрий – это светло-серебристый редкоземельный переходный металл. Существует в двух кристаллических модификациях: с гексагональной решеткой типа магния; и с кубической объёмно-центрированной решеткой типа альфа-феррум, температура перехода 1482*С.
В 1794 году финский химик Юхан (Иоганн) Гадолин выделил из минерала иттербита оксид элемента, который он назвал иттрием – по названию населенного пункта Иттербю, находящегося на острове Ресаре.
Иттрий – моно изотопный элемент, в природе представлен одним стабильным нуклидом 89Y. Иттрий-90 нашел применение в радионуклидной терапии онкологических заболеваний.
На воздухе иттрий покрывается плотной защитной оксидной пленкой. Для видимого света материал “иттралокс” (твердый раствор диоксида тория в окиси иттрия) прозрачен, как стекло, но также он хорошо пропускает инфракрасное излучение, поэтому его используют для изготовления инфракрасных “окон” специальной аппаратуры и ракет, а также используют в качестве смотровых “глазков” высокотемпературных печей. Плавится “иттралокс” лишь при температуре около 2207*С.
Оксид иттрия – чрезвычайно устойчивый к нагреву на воздухе огнеупор.
Легирование алюминия иттрием повышает на 7,5% электропроводность изготовленных из него проводов.
Напыление (детонационное и плазменное) иттрия на детали двигателей внутреннего сгорания позволяет увеличить износостойкость деталей в 400-500 раз по сравнению с хромированием.
40. Ряд 6. Группа 4. Цирконий Zr. Атомная масса 90,6. Простое вещество цирконий – это блестящий переходный металл серебристо-серого цвета. Обладает высокой пластичностью и устойчив к коррозии. Структура решетки: Гексагональная.
Цирконий в виде диоксида впервые был выделен в 1789 году немецким химиком М.Г.Клапротом в результате анализа минерала циркона (природного силиката циркония). В свободном виде цирконий впервые был выделен шведским химиком Берцелиусом в 1824 году. Свободный от примесей чистый цирконий удалось получить лишь более чем через 100 лет (А. ван Аркель, 1925 год).
Происхождение самого слова циркон неясно. Возможно, оно происходит от арабского zarkun (киноварь) или от персидского zargun (золотистый цвет).
Соединения циркония широко распространены в литосфере. Цирконий – литофильный элемент. В природе известны его соединения исключительно с кислородом в виде окислов и силикатов. Несмотря на то, что цирконий – рассеянный элемент, насчитывает около 40 минералов, в которых цирконий присутствует в виде окислов или солей.
Цирконий не играет биологической роли в организме. Металлический цирконий и его нерастворимые соединения (диоксид, силикат) обладают высокой биологической инертностью (свойством никак не взаимодействовать с тканями и жидкостями организма благодаря химической стойкости). О воздействии соединений циркония на организм ничего не известно.
Пыль циркония представляет собой вещество с большой пожаро- и взрывоопасностью, поскольку может самовоспламениться на воздухе.
41. Ряд 6. Группа 5. Ниобий Nb. Атомная масса 94,0. Простое вещество ниобий – блестящий переходный металл серебристо-серого цвета с кубической объёмно-центрированной кристаллической решеткой типа альфа-феррум, а = 0.3294. Для ниобия известны изотопы с массовыми числами от 81 до 113.
Ниобий был открыт в 1801 году английским ученым Чарльзом Хэтчетом в минерале, присланном еще в 1734 году в Британский музей из штата Массачусетс Джоном Уинтропом (внуком Джона Уинтропа младшего). Минерал был назван колумбитом , а химический элемент получил название колумбий (Cb) в честь страны, откуда был получен образец (Колумбии – торжественного названия США). В 1802 году А.Г.Экеберг открыл тантал, который практически совпадал по всем химическим свойствам с ниобием, и поэтому долгое время считалось, что это один и тот же элемент. Лишь в 1844 году немецкий химик Генрих Розе установил, что это отличный от тантала элемент и переименовал его в “ниобий” в честь дочери Тантала Ниобы, чем подчеркнул сходство между элементами. Однако в некоторых странах (США, Англии) долго сохранялось первоначальное название элемента – колумбий, и только в 1950 году решением Международного союза теоретической и прикладной химии элементу окончательно было присвоено название ниобий.
Близкие химические свойства ниобия и тантала обуславливают совместное их нахождение в одних и тех же минералах.
Из чистого ниобия или его сплавов изготавливают детали летательных аппаратов, оболочки для урановых и плутониевых тепловыделяющих элементов. Ниобий применяют в криотронах – сверхпроводящих элементах вычислительных машин.
42. Ряд 6. Группа 6. Молибден Мо. Атомная масса 96,0. Простое вещество молибден – мягкий, пластичный, блестящий переходный металл серебристо-белого цвета. Главное применение молибдена в металлургии. Структура решетки: Кубическая объемно-центрированная.
Открыт молибден в 1778 году шведским химиком Карлом Шееле, который прокаливая молибденовую кислоту, получил МоО3. В металлическом состоянии впервые получен П.Гьельмом в 1781 году восстановлением оксида углем, он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й.Берцелиус восстановлением оксида водородом.
Название происходит от др.-греч. “молибсос”, означающего “свинец”. Оно дано из-за внешнего сходства молибденита, минерала, из которого впервые удалось выделить оксид молибдена, со свинцовым блеском. Вплоть до 18 века молибденит не отличали от графита из-за свинцового блеска, эти минералы носили общее название “молибден”.
В свободном виде молибден не встречается. В земной коре молибден распространен относительно равномерно. Аномально высокое содержание молибдена наблюдается в звездных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда – объектах Ландау – Торна – Житковой.
При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400*С.
Молибден используется для легирования сталей как компонент жаропрочных и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампах накаливания.
Физиологическое значение молибдена для организма животных и человека было впервые показано в 1953 году, с открытием влияния этого элемента на активность фермента ксантиноксидазы. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Микро количества молибдена необходимы для нормального развития организмов, молибдат аммония используется в производстве микроудобрений, в частности, под ягодные и бобовые культуры. У растений молибден влияет на их размножение.
Следующий элемент в Периодической системе 1906 года отсутствовал, но мы его рассмотрим.
43. Ряд 6. Группа 7. Технеций Тс. Атомная масса 97,9. Простое вещество технеций – радиоактивный переходный металл серебристо-серого цвета. Самый легкий элемент, не имеющий стабильных изотопов. Первый из синтезированных химических элементов. Структура решетки: гексагональная.
Природный технеций является продуктом самопроизвольного деления урановой и ториевой руды или продуктом захвата нейтронов в молибденовых рудах. Весь остальной технеций на Земле произведен синтетически как продукт деления урана-235 в ядерных реакторах всех типов.
С 1860-х по 1871 год ранние формы Периодической таблицы, предложенные Д.И.Менделеевым, содержали разрыв между молибденом (элемент 42) и рутением (элемент 44). В 1971 году Менделеев предсказал, что пустующую ячейку под марганцем займет новый элемент “эка-марганец”, и будет иметь аналогичные химические свойства. Немецкие химики В.Ноддак, О.Берг, И.Такке открыли 75 и 43 элемент в 1925 году. Элемент под номером 43 они назвали “мазурием” в честь региона Мазурия. Название “технеций” новому элементу было предложено в 1947 году настоящими первооткрывателями – итальянскими исследователями К.Перрье и Э.Сегре. Название “технеций” взято из др.-греч. “технотос” – искусственный, отражая пионерское открытие элемента путем синтеза.
Широко используется в ядерной медицине для исследования мозга, сердца, щитовидной железы, легких, печени, желчного пузыря, почек, костей скелета, крови, а также для диагностики опухолей в компьютерной томографии.
Как элемент практически отсутствующий на Земле, технеций не играет естественной биологической роли.
44. Ряд 6. Группа 8. Рутений Ru. Атомная масса 101,7. Простое вещество рутений – это редкий переходный металл серебристо-белого цвета, относится к платиновым металлам. Структура решетки: гексагональная.
Рутений открыт профессором Казанского университета Карлом Клаусом в 1844 году. Клаус выделил рутений из уральской платиновой руды в чистом виде и указал на сходство между триадами: рутений – родий – палладий; и осмий – иридий – платина.
Первооткрыватель элемента К.К.Клаус назвал рутений в честь России (Ruthenia – латинское название Руси). Название “рутений” было предложено в 1828 году Г.В.Озанном для элемента, который он по ошибке принял за новый элемент, и Клаус, действительно открывший новый элемент в 1844 году, дал ему это название.
Мировые запасы рутения оцениваются в 5000 тонн. Цена рутения на 2016 год составляла 42 доллара за тройскую унцию (примерно 1.35 USD/г). Сейчас это 18 долларов за грамм.
Рутений обладает чрезвычайно большой твердостью, при этом он настолько хрупок, что его можно легко растереть в порошок. Он очень тугоплавок и плавится при значительно более высокой температуре, чем платина. В отсутствии кислорода на рутений не действует ни одна кислота, даже “царская водка”. Рутений образует ряд металлоорганических соединений и является активным катализатором.
Рутений получают как “отходы” при аффинировании платины и платиновых металлов.
Небольшая добавка рутения (0,1%) увеличивает коррозионную стойкость титана. В сплаве с платиной используется для изготовления чрезвычайно износостойких электрических контактов.
Рутений является единственным платиновым металлом, который обнаруживается в составе живых организмов. Концентрируется в основном в мышечной ткани. Высший оксид рутения крайне ядовит и, будучи сильным окислителем, может вызвать возгорание пожароопасных веществ.
45. Ряд 6. Группа 8. Родий Rh. Атомная масса 103,0. Простое вещество родий – это твердый переходный металл серебристо-белого цвета. Благородный металл платиновой группы. Структура решетки: кубическая гранецентрированная.
Родий открыт в Англии в 1803 году У.Г.Волластоном в ходе работ с самородной платиной. Волластон первым начал исследования свойства родия – определил его плотность и описал некоторые сплавы и соединения.
После открытия родий нашел лишь незначительное применение – на рубеже 20 века родий содержащие термопары использовались для изменения температуры до 1800*С. Однако наибольший спрос на родий возник после внедрения Volvo в 1976 году трехкомпонентного каталитического нейтрализатора, в котором платина и родий обеспечивают разложение оксидов азота на инертный молекулярный азот и кислород.
Волластон предложил название “Rhodium” как намек на др.-греч. “росзов” – роза, так как типичные соединения родия имеют глубокий темно-красный цвет. Именно соединения родия окрашивали в розовый цвет остаток раствора после осаждения из него платины в экспериментах Волластона. Еще более насыщенный к красному цвет можно увидеть, напрямую растворив металл в “царской водке”.
Родий очень редкий и рассеянный элемент. В природе встречается только изотоп 103Rh. Собственных минералов не имеет. Содержится в никелевых и платиновых рудах в виде простого соединения. Ежегодно в мире добывается менее 30 тонн родия.
Родий – благородный металл, по химической стойкости в большинстве коррозионных сред превосходит платину.
Соединения родия довольно редко встречаются в повсеместной жизни и их воздействие на человеческий организм до конца не изучено. В целом, они являются высокотоксичными и канцерогенными веществами. Соли родия способны сильно окрашивать человеческую кожу.
46. Ряд 6. группа 8. Палладий Pd. Атомная масса 106,5. Простое вещество палладий (при нормальных условиях) – это переходный благородный металл платиновой группы (легкие платиноиды) серебристо-белого цвета. Структура решетки: Кубическая гранецентрированная.
В 1803 году известный торговец минералами Форстер получил анонимное письмо с просьбой попытаться продать небольшое количество нового химического элемента “палладия”., слиток которого прилагался к письму. Таинственный металл был был выставлен на продажу и привлек всеобщее внимание. Химик Ричард Ченевикс желая разоблачить “мошенническую подделку”, купил слиток “палладия”. Вскоре он выступил с докладом в Лондонском королевском обществе, где объявил, что данный металл – всего лишь сплав платины с ртутью. Однако секретарь Уильям Хайд Волластон публично усомнился в выводах Ченевикса. А в 1804 году Волластон доложил королевскому обществу, что в платиновой руде из Южной Америки он обнаружил новые раннее неизвестные металлы – палладий и родий. Лишь в 1805 году было опубликовано открытое письмо Волластона, в котором он признался, что скандальная шумиха вокруг палладия – дело его рук.
Назван элемент по имени астероида Паллада, открытого немецким астрономом Ольберсом в 1802 году. В свою очередь, астероид назван в честь Афины Паллады из древнегреческой мифологии. Палладий или Палладиум, – упавшее с неба легендарное деревянное изображение Афины Паллады; согласно прорицанию Гелена (сына Приама), Троя останется несокрушимой, пока в ее стенах хранится этот талисман. Талисман выкрали Одиссей и Диомед, и Троя пала.
Палладий один из наиболее редких элементов в земной коре. Известно около 30 минералов палладия. Относится к сидерофилам, то есть обладает сродством к железу и концентрируется в ядре Земли. Палладий получают главным образом при переработке сульфидных руд никеля, серебра и меди.
Палладий часто применяется как катализатор, в основном в процессе гидрогенизации жиров, крекинге нефти, органическом синтезе.
Биологическая роль палладия в организме не установлена. Сам по себе металлический палладий нетоксичен, однако некоторые его соединения, например, хлорид палладия, очень ядовиты.
Ряд 7.
47. Ряд 7. Группа 1. Серебро Ag. Атомная масса 107,86. Простое вещество серебро – это ковкий, пластичный переходный благородный металл серо-белого цвета. Структура решетки: кубическая гранецентрированная.
Серебро известно человечеству с древнейших времен. Это связано с тем, что серебро, как и золото, часто встречается в самородном виде – его не приходилось выплавлять из руд. Это предопределило довольно значительную роль серебра в культурных традициях различных народов.
Сохранившиеся памятники наиболее ранней добычи серебра связаны с Хеттским царством. В Ассирии и Вавилоне серебро считалось священным металлом и являлось символом Луны.
Славянские названия металла – серебро, сребро, ст.-славянское сьребро. Этимология этого слова полностью не ясна, но больше похоже на то что оно обозначает “блестящий”, “сияющий”. Греческое название “аргурос”, латинское – “аргентум” произошло от индоевропейского корня “ерго” – белый, блистающий.
Определенная часть благородных и цветных металлов встречается в природе в самородной форме. Известны документально подтвержденные факты огромных самородков серебра. Так, например, в 1477 году в рудных горах в 45 км от города Фрайберг был обнаружен самородок серебра весом 20 тонн. Глыбу серебра размером 1х1х2,2 м выволокли из горной выработки, устроили на ней праздничный обед, а затем раскололи и взвесили.
Известно более 50 природных минералов серебра.
Серебро обладает наибольшей электропроводностью, теплопроводностью и стойкостью к окислению кислородом при обычных условиях, применяется для контактов электротехнических изделий (например, контакты реле, ламели), а также многослойных керамических конденсаторов.
Серебро с древних времен широко используется в ювелирном деле.
Следы серебра (порядка 0,02 мг/кг) содержатся в организмах всех млекопитающих, но его биологическая роль недостаточно изучена. Головной мозг человека характеризуется повышенным содержанием серебра (0,03 мг на 1000 г свежей ткани, или 0,002% по массе в золе). Интересно, что в изолированных ядрах нервных клеток – нейронов – серебра гораздо больше (0,08% по массе в золе).
С пищевым рационом человек получает в среднем около 0,1 мг серебра в сутки. Относительно много его содержит яичный желток (0,2 мг в 100 г). Выводится серебро из организма главным образом с калом.
Ионы серебра обладают бактериостатическими свойствами. Еще в древности воду для питья хранили в серебряных сосудах. Как и некоторые другие тяжелые металлы, серебро при избыточном поступлении в организм токсично. Содержание серебра в воде не должно превышать 0,05 мг/л.
В мифологии многих народов серебру приписываются магические свойства, способность отгонять всяческую нечисть – оборотней, вампиров, злых духов и т.д.
48. Ряд 7. Группа 2. Кадмий Cd. Атомная масса 112,4. Простое вещество кадмий (при нормальных условиях) – мягкий ковкий тягучий металл серебристо-белого цвета. Устойчив в сухом воздухе, во влажном на его поверхности образуется пленка оксида, препятствующая дальнейшему окислению металла. Кадмий и многие его соединения ядовиты. Структура решетки: гексагональная.
Открыт кадмий немецким профессором Ф.Штромейером в 1817 году. Провизоры Магдебурга при изучении оксида цинка заподозрили в нем примесь мышьяка. Штромейер выделил из ZnO коричнево- бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий.
Штромейер назвал кадмий по греческому названию руды, из которой в Германии добывали цинк, – “кадмеиа”. В свою очередь руда получила свое название в честь Кадма, героя древнегреческой мифологии.
Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. Известно всего лишь 6 кадмиевых минералов.
Кадмий расположен в одной группе Периодической системы с цинком и ртутью, занимая промежуточное место между ними, поэтому некоторые химические свойства этих элементов сходны.
Кадмий используется как компонент твердых припоев (сплавов на основе серебра, меди, цинка) для снижения их температуры плавления. 40% производимого кадмия используется для нанесения антикоррозионных покрытий на металлы, особенно устойчив к морской воде.
49. Ряд 7. Группа 3. Индий In. Атомная масса 115,0. Простое вещество индий – ковкий, легкоплавкий, очень мягкий металл серебристо-белого цвета. Сходен по химическим свойствам с алюминием и галлием, по внешнему виду – с цинком. Структура решетки: тетрагональная.
Индий обнаружили немецкие химики Ф.Райх и Т.Рихтер в 1863 году. Они искали таллий в цинковой обманке, однако вместо зеленой линии в спектре нашли яркую голубую линию. В 1867 году ими был предоставлен полукилограммовый слиток индия.
Яркая эмиссионная линия в спектре индия – цвета индиго.
Индий устойчив и не тускнеет в сухом воздухе при комнатной температуре, но выше 800*С горит фиолетово-синим пламенем с образованием оксида.
Широко применяется в производстве жидкокристаллических экранов для нанесения прозрачных пленочных электродов из оксида индия – олова. Используется в микроэлектронике как акцепторная примесь к германию и кремнию.
Индий не имеет ярко выраженной метаболической роли в организме. Соединения индия не всасываются в желудочно-кишечном тракте, умеренно всасываются при вдыхании. Индий может временно накапливаться в мышцах, в коже и костях человека, его период полувыведения около двух недель.
50. Ряд 7. Группа 4. Олово Sn. Атомная масса 119,0. Простое вещество (при нормальных условиях) – это пластичный, ковкий и легкоплавкий блестящий пост переходный металл серебристо-белого цвета. Известны четыре аллотропические модификации олова: ниже +13,2*С устойчиво альфа-олово (серое олово) с кубической решеткой алмазного типа; выше +13,2*С устойчиво бета-олово (белое олово) с тетрагональной кристаллической решеткой. При высоких давлениях обнаружены еще два вида олова.
Олово было известно человеку уже в 4 тысячелетии до н.э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди древних находок. Олово является (наряду с медью) одним из компонентов оловоносной бронзы. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было “стратегическим металлом” в течении всего “бронзового века”, более 2000 лет.
Латинское название stannum, связанное с санскритским словом, означающий ” стойкий, прочный”, первоначально относилось к сплаву свинца и серебра. Слово “олово” – общеславянское, однако в некоторых языках однокоренное слово используется для обозначения другого, внешне похожего металла – свинца. Оно является суффиксальным образованием от корня ol– , латинское albus – “белый”, так что металл назван по своему цвету.
Существовала “оловянная чума” – это когда при соприкосновении серого и белого олова приводит к “заражению” последнего. Одним из средств предотвращения “чумы” является добавление стабилизатора, например висмута. “Оловянная чума” – одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, пораженных “оловянной чумой. При нашествии Наполеоновской армии в 1812 году в Россию – сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок. Оловянная чума погубила многие музейные экспонаты.
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды.
Олово – редкий рассеянный элемент, по распространенности в земной коре занимает 47-е место.
О роли олова в живых организмах практически ничего не известно. Металлическое олово не токсично, что позволяет его применять в пищевой промышленности.
51. Ряд 7. Группа 5. Сурьма Sb. Атомная масса 120,2. Простое вещество сурьма – это полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, черная и желтая сурьма).
Русское слово “сурьма” произошло от турецкого и крымскотатарского surma, им обозначался порошок свинцового блеска PbS, также служивший для чернения бровей.
Сурьма известна с глубокой древности. В странах Востока она использовалась примерно за 3000 лет до н.э. для изготовления сосудов. В Древнем Египте уже в 19 веке до н.э. порошок сурьмяного блеска (природный Sb2S3) под названием mesten или stem применялся чернения бровей. В Древней Греции он был известен как “стиби”, отсюда лат. stibium.
Сурьма все больше применяется в полупроводниковой промышленности при производстве диодов, инфракрасных детекторов, устройств с эффектом Холла. Является компонентом свинцовых сплавов, увеличивающим их твердость и механическую прочность. Вместе с оловом и медью сурьма образует – бабит.
Сурьма токсична. Относится к микроэлементам. Постоянно присутствует в живых организмах, физиологическая и биохимическая роль до конца не изучена.
52. Ряд 7. Группа 6. Теллур Те. Атомная масса 127,6. Простое вещество теллур – хрупкий, малотоксичный редкий полуметалл (иногда его также относят к неметаллам) серебристо-белого цвета. Теллур является электронным аналогом кислорода, селена и серы, а также полония. Относится к халькогеннам. По химическим свойствам схож с селеном. Структура решетки: гексагональная.
Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Ф.Й.Мюллером (в последствии барон фон Райхенштейн), на территории Австро-Венгрии. В 1798 году Мартин Генрих Клапрот выделил теллур и определил важнейшие его свойства.
Название “теллур” происходит от латинского tellus, род. падеж telluris – “Земля” (название предложил Мартин Клапрот).
Среди всех неметаллов, имеющие стабильные изотопы, является самым редким в земной коре. Известно около 100 минералов теллура. Самородный теллур встречается вместе с селеном и серой. Теллур – редкий элемент, и значительный спрос при малом объеме добычи определяет высокую его цену (300 долл. за кг), но, не смотря на это, диапазон областей его применения постоянно расширяется.
Микро количества теллура всегда содержатся в живых организмах, его биологическая роль не выяснена. Теллур и его летучие соединения токсичны.
53. Ряд 7. Группа 7. Йод I. Атомная масса 126,9. Простое вещество йод (при нормальных условиях) – это кристаллы (формула – I2) черно-серого цвета с фиолетовым металлическим блеском, проявляющие неметаллические свойства и издающие характерный запах. Легко образует фиолетовые пары, обладающие резким запахом. Элементарный йод высоко токсичен. Структура решетки: орторомбическая.
Название элемента предложено Гей-Люссаком и происходит от др.греч. ” иоеисис” (букв. “фиалко-подобный”), что связано с цветом пара, который наблюдал французский химик Бернар Куртуа, нагревая маточный рассол золы морских водорослей с концентрированной серной кислотой.
Йод – редкий элемент. Он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространённым элементом, присутствует практически везде. Йод находится в виде иодидов в морской воде (20-30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях.
5-процентный спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения, но не для приема внутрь при дефиците йода в организме. При большом количестве внутри мышечных инъекций на их месте пациенту делается йодистая сетка. В криминалистике пары йода применяются для обнаружения следов рук на гладких поверхностях.
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и др.) накапливают до 1% йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и склеропротеинов морских многощетинковых червей.
У животных и человека йод входит в состав так называемых тироидных гормонов, вырабатываемых щитовидной железой, – тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
Ряд 8.
54. Ряд 8. Группа 0. Ксенон Хе. Атомная масса 128. Простое вещество ксенон – это тяжелый благородный одноатомный газ без цвета, вкуса и запаха. Структура решетки: кубическая гранецентрированная, кубическая атомная.
Ксенон был обнаружен как небольшая примесь к криптону. За открытие инертных газов (в частности ксенона) и определение их места в периодической таблице Менделеева Рамзай получил в 1904 году Нобелевскую премию по химии.
Рамзай предложил в качестве названия элемента древнегреческое слово “ксенон”, которое является формой среднего рода единственного числа от прилагательного “ксенос” т.е. “чужой, странный”. Название связано с тем, что ксенон был обнаружен как примесь к криптону, и с тем, что его доля в атмосферном воздухе чрезвычайно мала.
Ксенон – весьма редкий элемент. При нормальных условиях в кубометре воздуха содержится 0,086- 0,087 см3 ксенона. Ксенон также относительно редок в атмосфере Солнца, в составе астероидов и комет.
Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света. Жидкий ксенон иногда используется как рабочая среда лазеров.
В 2014 году Всемирное антидопинговое агентство приравняло ингаляции ксенона к применению допинга.
Газ ксенон нетоксичен, но способен вызвать наркоз (по физическому механизму), а в больших концентрациях (более 80%) вызывает асфиксию. Заполнение ксеноном легких и вдыхание при разговоре приводит к значительному понижению тембра голоса (эффект, обратный эффекту гелия). Фториды ксенона ядовиты.
55. Ряд 8. Группа 1. Цезий Cs. Атомная масса 132,9. Простое вещество цезий – это мягкий, вязкий щелочной металл серебристо-желтого цвета. Свое название цезий получил по цвету двух ярких синих линий в эмиссионном спектре (от лат. caesius – небесно-голубой). Структура решетки: кубическая объёмно-центрированная.
Цезий открыт в1860 году немецкими учеными Бунзеном и Кирхгофом в водах Бад-Дюркхаймского минерального источника в Германии методом оптической спектроскопии, став первым элементом, открытым при помощи спектрального анализа. В чистом виде цезий был выделен в 1881 году шведским химиком Карлом Сеттербергом при электролизе расплава смеси цеанида цезия и бария.
Мировая добыча обогащенной руды цезия составляет около 20 тонн в год. Мировой объем производства металлического (чистого) цезия – около 9 тонн в год.
В настоящее время цезий и его соединения используются в электронике, радио-, электро -, рентгенотехнике, химической промышленности, оптике, медицине, ядерной энергетике.
Хлорид рубидия и хлорид цезия участвуют в газовом обмене, активируя деятельность окислительных ферментов, соли этих элементов повышают устойчивость организма к гипоксии.
Цезий в живых организмах – постоянный химический микроэлемент организма растений и животных. Животные получают цезий с водой и пищей.
56. Ряд 8. Группа 2. Барий Ва. Атомная масса 137,4. Простое вещество барий – мягкий, вязкий, ковкий щелочноземельный металл серебристо-белого цвета. Обладает высокой химической активностью. Структура решетки: кубическая объемно-центрированная.
Барий был открыт в виде оксида ВаО в 1774 году Карлом Шееле и Юханом Ганом. В 1808 году английский химик Гемфри Дэви электролизом влажного гидроксида бария с ртутным катодом получил амальгаму бария, после испарения ртути при нагревании он выделил металлический барий.
Свое название получил от др.-греческого слова “барус” – “тяжелый”.
Барий применяется в вакуумных электронных приборах в качестве газопоглотителя, как антикоррозионный материал. Титанат бария используется в качестве диэлектрика. Так же барий используется в оптике, пиротехнике, атомно-водородной энергетике.
Барий относится к токсичным микроэлементам. В человеческом организме ионы бария оказывают выраженное влияние на гладкие мышцы.
Современная таблица Менделеева.
57. Ряд 8. Группа 3. Лантан La. Атомная масса 138,9. Простое вещество лантан – блестящий редкоземельный металл серебристо-белого цвета. Структура решетки: гексагональная.
Лантан как химический элемент не удавалось открыть на протяжении 36 лет. В 1803 году 24-летний шведский химик Йенс Якоб Берцелиус исследовал минерал, известный теперь под названием церит. В этом минерале была обнаружена иттриевая земля и еще одна редкая земля, очень похожая на иттриевую. Ее назвали цериевой. В 1826 году Карл Мосандер исследовал цериевую землю и заключил, что она не однородна, что в ней, помимо церия, содержится еще один новый элемент. Доказать сложность цериевой земли Мосандеру удалось лишь в 1839 году. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от др.-греч. “ланфано” – “скрываюсь”, “таюсь”.
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Основные промышленные минералы лантана – монацит, бастнезит, апатит и лопарит.
Впервые в истории лантан применяли в газокалильных сетках. Лантан применяется как компонент сплавов никеля, магния, кобальта и др.
В 1930-х годах советский ученый А.А.Дробков исследовал влияние редкоземельных металлов на культурные растения. Результаты опытов показали, что редкоземельные элементы, в том числе лантан, улучшают рост растений. Китай является лидером производства таких удобрений (РЗЭ).
Семейство лантаноидов.
58. Относится к семейству лантаноидов. Церий Се. Атомная масса 140,2. Простое вещество церий – это мягкий, пластичный редкоземельный металл серебристого цвета. Легко окисляется на воздухе. Структура решетки: Кубическая гранецентрированная.
Церий назван в честь самой большой из малых планет, Цереры (Ceres), в свою очередь, названной в честь римской Богини Плодородия.
Немецкий химик М.Г.Клапрот, открывший цериевую землю в 1803 г. почти одновременно со своими шведскими коллегами – В.Хизингером и Й.Я.Берцелиусом, возражал против названия “церий”, предлагая “церерий”. Берцелиус, однако, отстоял свое название, ссылаясь на трудности произношения того имени, которе предлагал новому элементу Клапрот.
Церий – это вязкий и ковкий серебристый металл, легко поддающийся ковке и механической обработке при комнатной температуре.
Церий – это редкоземельный металл, неустойчив на воздухе, постепенно окисляется, превращаясь в белый оксид и карбонат церия. При нагревании до +160*С на воздухе загорается, порошок церия является пирофорным. Церий реагирует с кислотами, при кипячении окисляется водой, устойчив к действию щелочей. Энергично взаимодействует с галогенами, халькогенами, азотом, углеродом.
Церий применяют в металлургии, химической и нефтяной промышленности как катализатор. Также используется при производстве стекла – такое стекло не тускнеет под воздействием радиации.
Оказывает токсическое действие на рыб и низшие водные организмы. Обладает способностью к биоаккумуляции.
59. Относится к семейству лантаноидов. Празеодим Pr. Атомная масса 140,91. Простое вещество празеодим – это умеренно мягкий редкоземельный металл серебристо-белого цвета. Структура решетки: Гексагональная.
Празеодим получил свое название от греческого слова “празиос” – “светло-зеленый и “сисумос” – “близнец”. Таким названием он обязан цвету его солей и истории открытия элемента.
Празеодим был открыт в 1885 году австрийским химиком Карлом Ауэром фон Вельсбахом. Он установил, что обнаруженный в 1839 году шведским химиком Карлом Мосандером элемент “дидим” является смесью двух элементов с близкими физическими и химическими свойствами, которым он дал названия “неодим” и “празеодим”.
Празеодим – умеренно мягкий, ковкий, вязкий металл серебристо-белого цвета. Не радиоактивен.
Фторид празеодима используется как лазерный материал. Оксид празеодима используется для варки стекла, придавая ему бледно-зеленую окраску. Сплавы празеодима с германием и кремнием используются как сверхпроводящие материалы.
60. Относится к семейству лантаноидов. Цериевая подгруппа. Неодим Nd. Атомная масса 144,24. Простое вещество неодим – мягкий металл серебристо-белого цвета с золотистым оттенком. Структура решетки: Гексагональная
Неодим был открыт в 1885 году австрийским химиком фон Вельсбахом.
Название “неодим” (лат. Neodymium) представляет собой слияние двух греческих слов “веос” “новый” и “сисумос” “близнец”, что связано с историей открытия элемента.
Неодим используется как компонент сплавов с алюминием и магнием для самолето- и ракетостроения.
Как и многие другие редкоземельные металлы, элементарный неодим не играет значительной биологической роли в живых организмах.
61. Относится к семейству лантаноидов. Прометий Pm. Атомная масса 144,9. Простое вещество прометий – это радиоактивный редкоземельный металл светло-серого цвета. В природе прометий практически не встречается, поскольку все его изотопы радиоактивны. Структура решетки: Гексагональная.
Этого элемента в таблице Менделеева за 1906 год нет, так как он был открыт в 1924 году.
62. Относится к семейству лантаноидов. Самарий Sm. Атомная масса 150,36. Простое вещество самарий – твердый редкоземельный металл серебристого цвета. Структура решетки: Ромбоэдрическая.
Элемент был выделен из минерала самарскита. Этот минерал в 1847 году был назван в честь русского горного инженера, полковника В.Е.Самарского-Быховца. В 1880 году в этом минерале был обнаружен новый элемент и был назван самарием; первый случай в истории, когда в названии химического элемента было отражено имя реально существовавшего человека, а не мифологического персонажа.
Самарий – это металл, напоминающий по внешнему виду свинец, а по механическим свойствам – цинк. Не радиоактивен. Является парамагнетиком.
Биологическая роль самария изучена слабо. Известно, что он стимулирует метаболизм. Токсичность самария и его соединений, как и у других редкоземельных элементов, невысока.
63. Относится к семейству лантаноидов. Европий Eu. Атомная масса 151,96. Простое вещество европий – это мягкий редкоземельный металл серебристо-белого цвета, легкоокисляющийся на воздухе.
Первыми спектральные линии, отнесенные впоследствии к европию, наблюдали Крукс (1886) и Лекок де Буабодран (1892). Демарсе обнаружил полосу спектра элемента в самариевой земле в 1896 году, а в 1901 году смог выделить элемент, описал его и дал ему название в честь Европы.
Вероятность попадания европия в организм человека представляется незначительной. Возможно поступление европия в организм человека с водой в микроскопических количествах. Нельзя исключать вероятности и других путей попадания в организм у людей, сталкивающихся с соединениями европия на производстве.
Европий относится к малотоксичным элементам. Нет какой-либо информации о последствиях воздействия европия на организм человека.
Европий является одним из самых дорогих лантаноидов и его цена достигает до 2000 долларов за кг.
64. Относится к семейству лантаноидов. Гадолиний Gd. Атомная масса 157,25. Простое вещество гадолиний – это мягкий редкоземельный металл серебристо-белого цвета. Структура решетки: Гексагональная.
Гадолиний открыт в 1880 году Жаном де Мариньяком, который спектроскопическим методом доказал присутствие нового элемента в смеси оксидов редкоземельных элементов. Элемент был назван по имени финского химика Юхана Гадолина.
Гадолиний – это мягкий, вязкий редкоземельный металл серебристо-белого цвета. Не радиоактивен. Является ферромагнетиком. В природе в основном встречается в солевой форме. Устойчив к щелочам. С галогенами реагирует. С серой реакция идет при нагреве. На воздухе покрывается защитной пленкой из оксида, что предохраняет его от дальнейшего окисления.
Гадолиний является ингибитором механо-чувствительных ионных каналов, обратимо блокирует их в микромолярных концентрациях. Также он может блокировать и некоторые другие ионные каналы.
65. Относится к семейству лантаноидов. Итриевая подгруппа. Тербий Tb. Атомная масса 158,9. Простое вещество тербий – мягкий металл серебристо-белого цвета. Как и любой лантаноид, тербий принадлежит к редкоземельным элементам и переходным металлам. Структура решетки: Гексагональная.
В 1843 году шведский химик К.Г.Мосандер обнаружил примеси в концентрате Y2O3. и выделил из него три фракции: иттриевую, розовую terbia (которая содержала современный элемент эрбий) и бесцветную erbia (содержала элемент тербий). Чистый тербий в начале 20 века получил французский химик Жорж Урбэн.
Наряду еще с тремя химическими элементами (эрбий, иттербий, иттрий) получил название в честь шведской деревни Иттербю, находящейся на острове Ресаре.
Тербий как простое вещество при нормальных условиях – пластичный, мягкий (тербий настолько мягок, что его можно резать ножом) металл серебристо-белого цвета. Легко поддается механической обработке. Природный тербий не радиоактивен.
Тербий применяется для производства магнитострикционных сплавов. Сплавы тербия с гадолинием имеют характеристики, подходящие для конструирования магнитных холодильников.
66. Относится к семейству лантаноидов. Диспрозий Dy. Атомная масса 162,5. Простое вещество диспрозий – это редкоземельный серебристо- серый металл. В чистом виде в природе не встречается, однако входит в состав некоторых минераловЮ напримерЮ ксенотима. Структура решетки: Гексагональная.
Диспрозий не радиоактивен. Является ферромагнетиком. В соединениях проявляет степень окисления +3. Металлический диспрозий медленно окисляется на воздухе при температуре 20*С. При нагревании металлический диспрозий реагирует с галогенами, азотом, водородом.
В 1886 году французский химик П.Э.Лекок де Буабодран выделил из руд эрбия новый элемент. Он назвал этот элемент диспрозием от греческого слова “диспрозитос”, что означает “трудно получить”.
Диспрозитос применяют в постоянных магнитах, используемых для ветряных турбин. Его также применяют в металлургии, лазерных материалах, как катализатор, в ядерной энергетике, в электронике, в источниках света.
Биологической роли не несет. Металлическая пыль диспрозия раздражает легкие.
67. Относится к семейству лантаноидов. Гольмий Но. Атомная масса 164,93. Простое вещество гольмий – это пластичный редкоземельный металл серебристо-белого цвета. Структура решетки: Гексагональная.
В 1879 году швейцарский физик и химик Жан-Луи Соре методом спектрального анализа обнаружил в “эрбиевой земле” новый элемент. Название элементу дал шведский химик П.Т.Клеве в честь Стокгольма (его старинное латинское название Holmia), так как минерал, из которого сам Клеве в 1879 году выделил оксид нового элемента, был найден близ столицы Швеции.
Среди космических объектов аномально высоким содержанием гольмия отличается звезда Пшибыльского.
Гольмий не радиоактивен. Является парамагнетиком. Он обладает самой высокой магнитной проницаемосью среди всех элементов и поэтому используется для полюсов самых сильных статических магнитов.
Гольмий не играет биологической роли в организме человека, но его соли способны стимулировать обмен веществ.
68. Относится к семейству лантоноидов. Эрбий Er. Атомная масса 167,25. Простое вещество эрбий – это мягкий редкоземельный металл серебристого цвета. Структура решетки: Гексагональная.
Впервые эрбий был выделен в 1843 году шведским химиком К.Г.Мосандром. Он обнаружил в гадолините три фракции и бесцветную он назвал “erbia”. Только в 1990-х годах китайский оксид эрбия упал в цене достаточно, чтобы использовать его как краситель для стекла.
Как и все редкоземельные металлы, эрбий не играет значительной биологической роли в живых организмах. Системная токсичность эрбия, по всей видимости, низкая.. Является стимулятором метаболизма.
69. Относится к семейству лантоноидов. Тулий Tm. Атомная масса 168,93. Простое вещество тулий – это легкообрабатываемый редкоземельный металл серебристо-белого цвета. Структура решетки: Гексагональная.
Тулий был открыт в 1879 году шведским химиком Пер Теодором Клеве. Его назвали “тулием” в честь легендарного острова Туле.
Тулий не радиоактивен. В стандартных условиях является парамагнетиком. В результате взаимодействия с кислородом тулий медленно тускнеет на воздухе и легко сгорает при 150*С с образованием оксида тулия. Сфера применения: лазерные материалы, термоэлектрические и др.
Тулий не играет никакой биологической роли.
70. Относится к семейству лантаноидов. Иттербий Yb. Атомная масса 173,05. Простое вещество иттербий – это глянцевитый редкоземельный металл светло-серого цвета. Структура решетки: Кубическая гранецентрированная.
Иттерий был открыт Жаном Шарлем Мариньяком в 1878 году в окиси эрбия. Наряду еще с тремя химическими элементами (тербий, эрбий и иттрий), этербий получил название в честь села Иттербю, находящегося на острове Ресаре, входящем в Стокгольмский архипелаг.
Иттербий – это вязкий и ковкий резкоземельный металл. Не радиоактивен. Является проводником. Применяется в лазерных, термоэлектрических, магнитных материалах, используется ядерной энергетике и электронике.
Содержание в человеческом организме: данные отсутствуют. Биологическая роль: отсутствует; мало токсичен; стимулятор.
71. Относится к семейству лантаноидов. Лютеций Lu. Атомная масса 174,96. Простое вещество лютеций – это плотный редкоземельный металл серебристо-белого цвета. Структура решетки: Гексагональная.
Элемент в виде оксида был открыт в 1907 году. Название элемента его первооткрыватель Жорж Урбэн произвел от латинского слова названия Парижа – Lutetia Parisiorum.
Ряд 8. (продолжение).
72. Ряд 8. Группа 4. Гафний Hf. Атомная масса 178,49. Простое вещество гафний – тяжелый тугоплавкий металл серебристо-белого цвета. Структура решетки: Гексагональная.
Элемент был открыт в 1923 году. В 1949 году название элемента “гафний” было утверждено Международной комиссией. Название элемента было дано в честь города где он был открыт Копенгаген (лат. Hafnia – латинское название Копенгагена).
73. Ряд 8. Группа 5. Тантал Та. Атомная масса 180,94. При стандартных условиях тантал – это блестящий переходный металл серебристо-белого цвета (со слабым свинцовым “синеватым” оттенком вследствие образования плотной оксидной пленки). Структура решетки: Кубическая объёмно-центрированная.
Тантал открыт в 1802 году шведским химиком А.Г.Экебергом в двух минералах, найденных в Финляндии и Швеции. Однако в чистом виде выделить его не удалось. Из-за трудностей получения этот элемент был назван по имени героя древнегреческой мифологии – царя Тантала.
Несмотря на высокую температуру плавления (3017*С), тантал пластичен, как золото. Чистый тантал хорошо поддается механической обработке, легко штампуется, раскатывается в проволоку и тончайшие листы толщиной в сотые доли миллиметра. Не становится хрупким при температуре жидкого азота (-196*С). Используется в жаропрочных и коррозионностойких сплавах, теплообменниках для ядерных энергетических систем, в оборонной промышленности для производства кумулятивных зарядов. Танталовая проволока используется в криотронах – сверхпроводящих элементах, устанавливаемых в вычислительной технике.
74. Ряд 8. Группа 6. Вольфрам W. Атомная масса 183,84. При нормальных условиях вольфрам – твердый, тяжелый блестящий металл серебристо-серого цвета. Обладает немного более высокой плотностью, чем металлический уран. Вольфрам – самый тугоплавкий из металлов. Относится к переходным металлам. Структура решетки: Кубическая объёмно-центрированная.
Название Wolframium перешло на элемент с элемента с минерала “вольфрамит”. известного еще с 16 века под названием “волчья пена” – лат. spuma lupi или нем. Wolf Rahm. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков (“пожирая олово как волк овцу”).
Вольфрам встречается в природе в основном в виде окисленных сложных элементов. Тугоплавкость вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а также кинескопах и других вакуумных трубках. Вольфрам используют в качестве электродов для аргонно- дуговой сварки. Он также является основой тяжелых сплавов из которых делают бронебойные сердечники.
Вольфрам не играет значительной биологической роли. У некоторых архибактерий и бактерий имеются ферменты, включающие вольфрам в своем активном центре. Присутствие вольфрама в составе ферментов может рассматриваться как физиологический реликт раннего архея – существуют предположения, что вольфрам играл роль в ранних этапах возникновения жизни.
75. Ряд 8. Группа 7. Рений Re. Атомная масса 186,2. При стандартных условиях простое вещество рений представляет собой тяжелый металл серебристо-белого цвета. Самый тугоплавкий металл после вольфрама. Структура решетки: Гексагональная (плотноупакованная).
Название элемента происходит от латинского “Rhenus” – наименование реки Рейн в Германии.
Существование рения было предсказано Д.И.Менделеевым (“тримарганец”) в 1871 году, по аналогии элементов в группе периодической системы, однако “двимарганец” (английское “dvi-manganese”) использовалось гораздо чаще. Подтверждение этому было получено Генри Мозли в 1914 году. Сам элемент открыли в 1925 году.
Рений стал последним открытым элементом, у которого известен стабильный изотоп.
Крупнейшим производителем первичного рения является чилийская компания “Молимет”. Мировое производство рения достигает до 60 тонн в год.
Рений – один из редчайших элементов земной коры. 1 кг рения стоит до 10000 долларов. Рений является дорогим и редким металлом, поэтому его использование ограничено теми случаями, когда они дают исключительные преимущества перед использованием других металлов. Сплавы никеля и рения используются для изготовления лопаток газотурбинных двигателей.
Рений не участвует в биохимических процессах и не играет биологической роли.
76. Ряд 8. Группа 8. Осмий Os. Атомная масса 190,23. Осмий – серо-голубоватый, твердый, но хрупкий металл с очень высокой удельной массой. Структура решетки: Гексагональная.
Название осмия происходит от др.- греч. “осмиимн” “запах”, так как химические реакции растворения щелочного сплава “осмиридия” (нерастворимого остатка платины в “царской водке”) в воде или кислоте сопровождаются выделением неприятного запаха, стойкого запаха тетра оксида осмия OsO4, раздражающего горло, похожего на запах хлора или гнилой редьки.
Осмий был открыт в 1803 году английским химиком Смитсоном Теннантом. Гипотетическому элементу было присвоено имя “птен” (греч.”крылатый”), однако, в опытах Теннант продемонстрировал, что это смесь двух элементов – иридия и осмия.
Осмий сохраняет свой блеск даже при высоких температурах. С трудом поддается механической обработке. Осмий плавится при 3033*С.
Высокая твердость и исключительная тугоплавкость позволяет использовать осмий в качестве покрытия в узлах трения.
Не играет биологической роли. Тетрадоксид осмия вызывает раздражение глаз, верхних дыхательных путей, пневмонию, воспаление почек.
77. Ряд 8. Группа 8. Иридий Ir. Атомная масса 192,22. Простое вещество иридий – очень твердый, тугоплавкий, серебристо-белый переходный металл платиновой группы, обладающий высокой плотностью и сравнимый по этому параметру только с осмием. Имеет высокую коррозионную стойкость даже при температуре 2000*С. В земных породах встречается крайне редко, поэтому высокая концентрация иридия в образцах породы является индикатором космического (метеоритного) происхождения последних. Структура решетки: Кубическая гранецентрированная.
Иридий был открыт в 1803 году английским химиком С.Таннатом одновременно с осмием, которые присутствовали в природной платине из Южной Америки.
Иридий (др.-греч. “ирис” – “радуга”) получил такое название благодаря разнообразной окраске своих солей.
Содержание иридия в земной коре ничтожно мало, он встречается гораздо реже золота и платины. Иридий часто встречается в метеоритах. Высокая плотность и высокое сродство к железу могли привести к смещению иридия в глубь земли в ядро планеты. Наибольшее количество иридия было обнаружено в фотосфере Солнца.
Ежегодное производство иридия на Земле составляет около 3 тонн. Цена за 1 кг составляет 17 тыс. долларов.
Иридий – тяжелый серебристо-белый металл, из-за своей твердости плохо поддается механической обработке. Температура плавления 2466*С.
Основное применение иридия – оборудование для выращивания монокристаллов, где иридий используют в качестве материала для тиглей.
Иридий не играет никакой биологической роли. Металлический иридий не ядовит, но некоторые соединения иридия, например, его гексафториды очень ядовиты.
78. Ряд 8. Группа 8. Платина Pt. Атомная масса 195,08. Простое вещество платина – блестящий и очень тяжелый благородный металл серебристо-белого цвета. Структура решетки: Кубическая гранецентрированная.
В Старом Свете платина не была известна до середины 16 века, однако цивилизация Анд (инки и чибча) добывали и использовали ее с незапамятных времен.
Историческая справка: В 1735 году испанский король издает указ, повелевающий платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевать тщательно отделять ее от золота и топить под надзором королевских чиновников в глубоких местах речки Рио-дель- Пинто. А ту платину, которая уже привезена в Испанию, повелевалось всенародно и торжественно утопить в море. Королевское распоряжение было отменено через 40 лет, когда мадридские власти начали фальсифицировать золотые и серебряные монеты.
Историческая справка: В последствии с платиной познакомились алхимики. Необычно плотная платина оказалась тяжелее золота, поэтому они посчитали ее непригодным металлом и наделили адскими чертами. Некоторое применение платина нашла позже во Франции, когда из нее был изготовлен эталон метра, а позже эталон килограмма.
Название “платина” было дано испанскими конкистадорами. Когда они познакомились с новым металлом, внешне похожим на серебро (исп. plata). Слово буквально обозначает “маленькое серебро”, “серебришко”. Объясняется такое пренебрежительное название исключительной тугоплавкостью платины, которая не поддавалась переплавке, долгое время не находила применения и ценилась вдвое ниже, чем серебро. В настоящее время ее стоимость относительно серебра выше примерно в 42 раза.
Самородную платину добывают на приисках как серебро и золото. К концу 19 века в Российской империи добывалось платины в 40 раз больше, чем в остальных странах мира, причем представлена она была и весьма увесистыми самородками до 10 кг. Но платина не находила достойного применения и с 1828 года в Российской империи начали выпускать платиновые монеты номиналом 3; 6 и 12 рублей. В СССР добыча платины была засекречена.
По всей видимости, платина не играет ярко выраженной биологической роли в организме человека, как и все платиноиды. В металлическом виде платина не токсична, однако некоторые соединения (например, гексафторид платины), очень ядовиты.
Ряд 9.
79. Ряд 9. Группа 1. Золото Au. Атомная масса 196,96. Простое вещество золото – благородный металл желтого цвета. Структура решетки: кубическая гранецентрированная.
Русское слово “золото” восходит к праславянскому “золто”, что означает “желтый, золотистый, зеленоватый”.
Чистое золото – мягкий металл, из-за релятивистских эффектов электронов имеющий желтый цвет. Красноватый оттенок золоту придает медь. В тонких пленках золото просвечивает зеленым.
Золото обладает высокой теплопроводностью и низким электрическим сопротивлением. Золото – очень тяжелый металл, среди металлов по плотности занимает седьмое место. Золото – один из самых инертных металлов, стоящих в ряду напряжений правее других металлов.
Золото усиливает бактерицидное действие серебра, оно оказывает антимикробное, а также противовирусное действие. Само по себе золото не токсично для человеческого организма. Ионы золота участвуют в нормализации иммунных процессов в организме. Их недостаток в организме может привести к появлению таких заболеваний, как полиартрит, гипертония, заболевания печени. Некоторые соединения золота в организме небезопасна.
80. Ряд 9. Группа 2. Ртуть Hg. Атомная масса 200,59. Простое вещество ртуть – переходный металл, при комнатной температуре представляющий собой тяжелую серебристо-белую жидкость, пары которой чрезвычайно ядовиты, кондоминат. Ртуть – один из двух химических элементов ( и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент – бром). Структура решетки: ромбоэдрическая.
Ртуть – один из семи металлов, известных с древнейших времен. Нередко ее находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом ее основного минерала – киновари. Киноварную краску находят территории Турции, которой более 8 тыс. лет. В Египте был найден сосуд с ртутью, датированный 15-16 веками до н.э. С 15 века ртуть применялась как лекарственное средство, ее применение описал сам Парацельс.
Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий, в честь греко-римского бога Гермеса – быстро перемещающегося вестника Богов.
Русское название ртути происходит от праслав. “рьтоуть” и обозначает слово “катиться”.
Ртуть – относительно редкий элемент в земной коре. Ртуть присутствует в большинстве сульфидных минералов. Ртуть – малоактивный металл. В сухом воздухе не изменяется.
Ртуть в атмосферу попадает за счет выбросов вулканов и сжигания каменного угля.
Ртуть и многие ее соединения ядовиты. Воздействие ртути – даже в небольших количествах – может вызвать серьезные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребенка на ранних стадиях.
81. Ряд 9. Группа 3. Таллий Tl. Атомная масса 204,38. Таллий – мягкий металл серебристо-белого цвета с серовато-голубым оттенком, быстро окисляющийся на воздухе в виду своей высокой химической активности. Структура решетки: гексагональная.
Таллий был открыт спектральным методом в 1861 году английским ученым Уильямом Круксом в шламах свинцовых камер сернокислотного завода вблизи города Абберода, расположенного в горном массиве Гарц.
Название элемент получил по характерным зеленым линиям своего спектра и зеленой окраске пламени. От др.-греч. “таллос” – молодая зеленая ветвь.
82. Ряд 9. Группа 4. Свинец Pb. Атомная масса 207,2. Простое вещество свинец – ковкий, сравнительно легкоплавкий тяжелый металл серебристо-белого цвета с синеватым отливом. Свинец и его соединения токсичны, при этом органические соединения свинца более опасны, чем неорганические. Известен с глубокой древности. Структура решетки: Кубическая гранецентрированная.
Свинец используется многие тысячелетия, поскольку широко распространен, легко добывается и легко плавится. Выплавка свинца была первым из известных человеку металлургических процессов. В Древнем Египте использовались медальоны из свинца. В раннем бронзовом веке свинец использовался наряду с сурьмой и мышьяком.
Историческая справка: Свинцовый сахар еще с римских времен добавляли в вино для улучшения его вкусовых качеств, это стало широко применяться и продолжалось даже после запрета папской буллой в 1498 году. Такое использование свинца в средние века приводило к эпидемиям “свинцовой колики”.
Историческая справка: В Древней Руси свинец использовали для покрытия крыш церквей, а также широко применяли в качестве материала навесных печатей к грамотам.
В алхимии свинец ассоциировалсяс планетой Сатурн.
До 1990 года большое количество свинца использовалось (вместе с сурьмой и оловом) в типографических сплавах для отливки типографических шрифтов, а также в производстве в производстве тетраэтилсвинца, применяемого для повышения октанового числа моторного топлива. Основное применение свинец в настоящее время находит в производстве свинцово-кислотных аккумуляторных батарей для автомобильной промышленности.
Происхождение слова “свинец” не ясно. Во многих славянских языках его называют “олово”. Но похоже что слово имеет один извод со словом “синева”, “свинцовый” – от цвета самого металла. Латинское plumber – “водопроводчик” (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для ковки полос и пайки).
Историческая справка: Название венецианской тюрьмы со свинцовой крышей – Пьомби, из которой, по некоторым данным, ухитрился бежать Казанова.
Самородный свинец встречается редко, виды горных пород, в которых присутствует свинец, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. Свинец входит в состав 80 различных минералов.
Свинец имеет довольно низкую теплопроводность. Металл мягкий, режется ножом, легко царапается ногтем. Его поверхность обычно покрыта более или менее толстой пленкой оксидов, на срезе имеет металлический блеск, который на воздухе со временем тускнеет. Температура плавления 328*С.
Измерение содержания изотопов свинца используется для определения возраста минералов и горных пород в абсолютной геохронологии.
Свинец и большинство его соединений токсичны, являются потенциальными канцерогенами для организма человека.
83. Ряд 9. Группа 5. Висмут Bi. Атомная масса 208,98. Простое вещество висмут представляет собой при нормальных условиях блестящий серебристый с розоватым оттенком металл. При атмосферном давлении существует в ромбоэдрической кристаллической модификации.
Природный висмут имеет крайне медленный альфа-распад. Период полураспада составляет 1,9 *10в 19 степени лет, что больше возраста. Вселенной на 9 порядков.
Предположительно латинское Bismuthum происходит от немецкого weise Masse, “белая масса”.
В Средневековье висмут часто использовался алхимиками во время опытов. Добывающие руду шахтеры называли его tectum argenti, что обозначает “серебряная крыша”, при этом они считали, что висмут был наполовину серебром.
Висмут – достаточно редкий металл, его мировая добыча составляет 6000 тонн в год. Его используют в металлургии, в производстве полимеров, при крекинге нефти, получения полония-210, в ядерной энергетике, косметике. Оксид хлорид висмута применяется как блеск-образователь в производстве лака для ногтей, губной помады, теней и т.д.
84. Ряд 9. Группа 6. Полоний Ро. Атомная масса (209). Относится к группе халькогенов. При нормальных условиях представляет собой мягкий радиоактивный металл (согласно другим данным – полуметалл) серебристо-белого цвета. Структура решетки: кубическая.
Элемент открыт в 1898 году супругами Кюри. Элемент был назван в честь родины Марии Склодовской-Кюри – Польши (лат. Polonia).
Полоний всегда присутствует в урановых и ториевых минералах. Полоний-210 в сплавах с бериллием и бором применяется для изготовления компактных и очень мощных нейтронных источников. Полоний-210 обладает особо высокой радио токсичностью и является канцерогеном, имеет период полураспада 138 дней и 9 часов.
Историческая справка: Александр Литвиненко скончался в 2006 году в результате отравления полонием-210. Полоний был обнаружен в личных вещах Ясира Арафата, который скончался в 2004 году.
Полоний-210 в небольших количествах находится в природе и накапливается в табаке, вследствие чего является одним из заметных факторов, который наносит вред курильщику.
85. Ряд 9. Группа 7. Астат At. Атомная масса (210). Астат – самый редкий природный элемент Периодической системы, поэтому он был синтезирован искусственно до того как был обнаружен в природе. Во всей земной коре его насчитывается не более 1 грамма.
Предсказан (как “эка-иод”) Д.И.Менделеевым в 1898 году. Был открыт в 1931 году американцем Ф.Аллисон.
Астат – твердое вещество сине-черного цвета, по внешнему виду похожее на йод. Будучи схожим по химическим свойствам на йод, астат радиотоксичен.
86. Ряд 9. Группа 8. Радон Rn. Атомная масса (222). Простое вещество радон при нормальных условиях – бесцветный инертный газ. Радиоактивен, стабильных изотопов не имеет, может представлять опасность для здоровья и жизни. При комнатной температуре является одним из самых тяжелых газов. Наиболее стабильным изотопом является элемент с атомным весом 222, имеющий период полураспада 3,8 суток. Структура решетки: Кубическая гранецентрированная.
Радон был обнаружен в 1899 году Пьером и Марией Кюри. Впервые его выделили в чистом виде в 1908 году.
Радон используют в медицине для приготовления радоновых ванн. Радон используют в сельском хозяйстве для активации кормов домашних животных. он так же используется в металлургии и геологии.
Радон вреден для здоровья, он радиотоксичен и канцерогенен. Попадая в организм человека, он способствует процессам, приводящим к раку легких.
Ряд 10.
87. Ряд 10. Группа 1. Франций Fr. Атомная масса (223). Франций – самый тяжелый щелочной металл, по свойствам он больше всего напоминает цезий. Структура решетки: кубическая объемно- центрированная.
Самый редкий природный элемент после астата, в природе встречается в ничтожно малых количествах.
Этот элемент был предсказан Д.И.Менделеевым (как “эка-цезий”) еще в 1870 году. Открыт был “франций” только в 1939 году, через 69 лет после предсказания Менделеева, как продукт распада актиния.
88. Ряд10. Группа 2. Радий Ra. Атомная масса (226). Простое вещество радий – это блестящий щелочноземельный металл серебристо-белого цвета, быстро тускнеющего на воздухе. Обладает высокой химической активностью, очень ядовит. Соединения радия намного более токсичны, чем соединения бария, из-за высокой радиоактивности радия. Структура решетки: кубическая объемно- центрированная.
Среди изотопов радия наиболее устойчив нуклид радия-226 (период полураспада 1600 лет.
Первое открытие радия ( в виде смеси с барием) супруги Кюри сделали 26 декабря 1898 года. В 1910 году Мария Кюри и Андре Дебьерн выделили чистый радий. Выделенный элемент представлял собой изотоп радий-226, продукт распада урана-238.
Название “радий” связано с излучением ядер атомов Ra (лат. radius – “луч”).
Радий довольно редок. За прошедшее с момента его открытия время – более столетия – во всем мире удалось добыть всего 1,5 кг чистого радия.
Радий в организме человека ведет себя подобно кальцию, он накапливается в костной ткани, что приводит к самопроизвольным переломам костей.
89. Ряд 10. Группа 3. Актиний Ас. Атомная масса (227). Возглавляет семейство актиноидов. Простое вещество актиний (при нормальных условиях) – это тяжелый радиоактивный металл серебристо- белого цвета. Структура решетки: кубическая гранецентрированная.
Актиний был открыт в 1899 году А.Дебьерном в отходах от переработки урановой смолки, из которой удалили полоний и радий. Новый элемент был назван “актинием”.
Название происходит от др.-греч. “актис” – “луч”.
Актиний является одним из самых малораспространенных в природе радиоактивных элементов. Общее количество в коре не превышает 2600 тонн.
Актиний – это металл серебристо-белого цвета, тяжелый, мягкий, по внешнему виду напоминает лантан. Радиоактивен. Вследствие радиоактивности в темноте светится характерным голубым цветом.
Семейство актиноидов.
90. Относится к семейству актиноидов. Торий Th. Атомная масса 232,03. Простое вещество торий – тяжелый слаборадиоактивный металл серебристо-белого цвета. Структура решетки: кубическая гранецентрированная.
Впервые торий был выделен Йенсом Берцелиусом в 1928 году из минерала торит (содержит силикат тория). Первооткрыватель назвал элемент в честь Бога Грома из скандинавской мифологии – Тора.
Элемент был открыт после смерти Д.Менделеева.
91 Относится к семейству актиноидов. Протактиний Ра. Атомная масса 231,03. Простое вещество протактиний – это плотный радиоактивный металл светло-серого цвета. Структура решетки: тетрагональная.
Стабильный протактиний был обнаружен в 1918 году Отто Ганом и Лизой Мейтнер. Они выбрали название “прото-актиний”.
Элемент был открыт после смерти Д.Менделеева.
92. Относится к семейству актиноидов. Уран U. Атомная масса 238,02. Простое вещество уран – слаборадиоактивный металл серебристо-белого цвета. В чистом виде он немного мягче стали, ковкий, гибкий, обладает парамагнитными свойствами. Температура плавления 1132,3*С. Структура решетки: орторомбическая.
Уран не имеет стабильных изотопов. Самыми распространенными изотопами являются уран-238 (период полураспада 4,47*10 в 9 степени лет) и уран-235 (пер. полураспада 7,13*10 в 8 степ. лет).
Еще в древнейшие времена природная окись урана использовалась для изготовления желтой посуды. В 1789 году химик М.Г.Клапрот из саксонской руды извлек “желтую землю”. В честь самой далекой из известных тогда планет (открытой 8 годами раньше) новое вещество назвал “ураном”. В 1840 году Пелиго удалось получить простое вещество уран – тяжелый металл серо-стального цвета.
В 1874 году Д.И.Менделеев поместил уран в Периодической таблице в самой дальней клетке своей таблицы.
В 1896 году, исследуя уран, французский ученый Антуан Анри Беккерель случайно открыл радиоактивный распад. В 1899 году Эрнест Резерфорд обнаружил два вида излучения – альфа- и бета-лучи, в 1900 году открыли и третий вид излучения – гамма-лучи.
Количество урана в земной коре примерно в 1000 раз больше количества золота, в 30 раз серебра, равен показателю свинца и цинка.
Уран используется как ядерное топливо. Используют его в геологии для определения возраста минералов.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений.
93. Относится к семейству актиноидов. Нептуний Np. Атомная масса (237). Простое вещество нептуний – это первый радиоактивный трансурановый металл серебристо-белого цвета. Структура решетки: орторомбическая.
Нептуний впервые был получен в 1940 году с помощью бомбардировке ядра урана нейтронами.
Название нептуния образовано от названия восьмой планеты в Солнечной системе – планеты Нептун.
94. Относится к семейству актиноидов. Плутоний Рu. Атомная масса (244). Плутоний – тяжелый хрупкий высокотоксичный радиоактивный металл серебристо-белого цвета. Структура решетки: моноклинная.
В 1934 году Энрико Ферми открыл химический элемент под номером 94. В 1930 году была открыта новая планета Плутоний. В греческой мифологии Аид (в римской Плутон) является Богом царства мертвых.
Элемент был открыт после смерти Д.Менделеева.
95. Относится к семейству актиноидов. Америций Am. Атомная масса (243). Америций – четвертый синтезированный трансурановый элемент. Все изотопы радиоактивны. Простое вещество америций – тяжелый металл серебристо-белого цвета. Структура решетки: гексагональная.
Элемент был получен искусственно в 1944 году в Чикагском университете. Внешняя электронная оболочка нового элемента оказалась аналогичной электронной оболочке европия. Поэтому элемент назвали америцием в честь Америки, как европий – в честь Европы.
Элемент был открыт после смерти Д.Менделеева.
96. Относится к семейству актиноидов. Кюрий Cm. Атомная масса (247). Простое вещество кюрий – это синтезированный радиоактивный трансурановый металл серебристого цвета. Структура решетки: гексагональная.
Первым из элементов в Чикагском университете в 1944 году был получен “кюрий”. Назван в честь Пьера и Марии Кюри.
Элемент был открыт после смерти Д.Менделеева.
97. Относится к семейству актиноидов. Берклий Вk. Атомная масса (247). Берклий не имеет стабильных изотопов, наиболее долгоживущий нуклид 247Вk имеет период полураспада 1380 лет. Структура решетки: гексагональная.
Элемент был назван в честь города Беркли (Калифорния), в котором он был впервые получен в 1947 году.
Элемент был открыт после смерти Д.Менделеева.
98. Относится к семейству актиноидов. Калифорний Cf. Атомная масса (251). Известны радиоизотопы с массовыми числами 237-256. Стабильных изотопов не имеет. Структура решетки: гексагональная.
Данный элемент был впервые синтезирован в 1950 году в Национальной лаборатории им. Лоуренса в Беркли Калифорнийского университета. Назван в честь Калифорнийского университета.
Элемент был открыт после смерти Д.Менделеева.
99. Относится к семейству актиноидов. Эйнштейний Es. Атомная масса (253). Является элементом с самым большим атомным номером, который был получен в весовых количествах. Ежегодно производится несколько миллиграммов эйнштейния. Простое вещество эйнштейний – это радиоактивный трансурановый металл серебристого цвета.
Эйнштейний был открыт в декабре 1952 года в радиоактивных осадках. Элемент был назван в честь Альберта Эйнштейна.
Элемент был открыт после смерти Д.Менделеева.
100. Относится к семейству актиноидов. Фермий Fm. Атомная масса (257). Как и прочие элементы тяжелее плутония, в природе не обнаружен, все известные изотопы получены искусственно.
Впервые получен американцем Гиорсо в конце 1952 года в Лос-Аламосской лаборатории. Назван по имени одного из пионеров ядерной физики итало-американского физика Энрико Ферми.
Элемент был открыт после смерти Д.Менделеева.
101. Относится к семейству актиноидов. Менделевий Md. Атомная масса (258).
Первые атомы менделевия синтезировали американские ученые в 1955 году. А в 1962 году учеными Объединённого института ядерных исследований в Дубне были получены сотни атомов нового вещества. Назван по предложению американских ученых в честь русского ученого-химика Дмитрия Ивановича Менделеева – создателя Периодической системы химических элементов.
102. Относится к семейству актиноидов. Нобелий No. Атомная масса (259).
Первый об открытии 102 элемента заявила в 1957 году группа ученых, работавших в Стокгольме (Швеция). Они же и предложили назвать элемент нобелий в честь Альфреда Нобеля.
Комментарий: Менделев и Нобели были заклятыми врагами на почве того что Менделеев вмешивался в дела Нобелей при разработке нефтяных разработок Баку. Нобели так и не дали свою премию выдающемуся русскому ученому. Так же Нобели блокировали получения звания Академика. Как терпят два названия на тонком эфирном плане друг друга в Таблице Менделеева?
103. Относится к семейству актиноидов. Лоуренсий Lr. Атомная масса (266).
Элемент 103 был получен в СССР в Объединенном институте ядерных исследований (Дубна) в 1965 году. Американцы дали название в честь физика Эрнеста Лоуренса.
Ряд 10. (продолжение).
104. Ряд 10. группа 4. Резерфордий Rf. Атомная масса (267). До 1997 года в СССР был известен как “курчатовий (Ku)”. Резерфордий – высокорадиоактивный искусственно синтезированный элемент, период полураспада 1,3 часа.
Впервые 104 элемент был синтезирован в 1964 году учеными из г. Дубна. В 1997 году “курчатовий” был переименован в “резерфордий” в честь английского физика Эрнеста Резерфорда.
105. Ряд 10. Группа 5. Дубний Db. Атомная масса (268). Период полураспада наиболее стабильного из известных изотопов элемента 268Db составляет около 16 часов.
Элемент 105 был получен на ускорителе в Дубне в 1970 году группой Георгия Флерова. Решением ИЮПАК в 1997 году элемент получил название “дубний – в честь российского центра по исследованиям в области ядерной физики, наукограда Дубны.
106. Ряд 10. Группа 6. Сиборгий Sg. Атомная масса (269). Сиборгий ранее был известен как “эко- фольфрам” и под временным систематическим названием “уннилгексий”.
Сиборгий синтезирован в 1974 году в Лаборатории им. Лоуренса Калифорнийского университета в Беркли. Элемент назван в честь американского физика из Беркли Гленна Сиборга (1912-1999).
107. Ряд 10. Группа 7. Борий Bh. Атомная масса (270). Структура решетки: гексагональная плотноупакованная.
107-й элемент впервые был синтезирован в академгородке Дубне в 1976 году. Назван в честь датского физика Нильса Бора.
108. Ряд 10. Группа 8. Хассий Hs. Атомная масса (270). Предположительно серебристо-белый металл, по химическим свойствам является аналогом осмия. Структура решетки: предположительно гексагональная плотноупакованная.
Элемент 108 был открыт в 1984 году в Центре исследования тяжелых ионов, Дармштадт, Германия. Название хассий дано в честь земли Гессен (Hassia – лат.).
109. Ряд 10. Группа 8. Мейтнерий Mt. Атомная масса (278). В природе отсутствует, синтезирован искусственно. Ранее был известен как “уннилений” или “эка-иридий”.
Впервые получен в 1982 году в Дармштадт, Германия. Название предложено в честь австрийского физика Лизы Мейтнер.
110. Ряд 10. Группа 8. Дармштадтий Ds. Атомная масса (281).
Элемент получил название по месту открытия, Дармштадт, Германия.. Синтезирован 9 ноября 1994 года.
Ряд 11.
111. Ряд 11. Группа 1. Рентгений Rg. Атомная масса (282). Ранее он назывался “унунуний” или “эка- золото”. Простое вещество рентгений – переходный металл. Наиболее долгоживущий, период полураспада 2,1 минуты).
Предполагается, что рентгений – переходный металл, аналог золота. Рентгений относится к группе благородных металлов, и предполагается, что он является химически малоактивным металлом. Так как активность благородных металлов снижается с ростом порядкового номера, то предполагается, что рентгений еще менее активен, чем золото, и таким образом, является самым химически инертным металлом.
Элемент 111 был впервые синтезирован 8 декабря 1994 года в немецком городе Дармштадте.
112. Ряд 11. Группа 2. Коперниций Cn. Атомная масса (285). Ядро наиболее стабильного изотопа состоит из 112 протонов, 173 нейронов и имеет период полураспада около 34 секунды. Относится к той же химической группе, что и цинк, кадмий и ртуть.
Открытие 112 элемента было признано в мае 2009 года. Название дано в честь астронома Николая Коперника.
113. Ряд 11. Группа 3. Нихоний Nh. Атомная масса (286). Ранее фигурировал под названиями “унунтрий” или “эка-таллий”. Период полураспада 20 секунд. Как и все сверхтяжелые элементы, чрезвычайно радиоактивен.
Элемент 113 был синтезирован 10 августа 2003 года в Дубне, Россия, на циклотроне У-400. * июня 2016 года ИЮПАК дал элементу название “нихоний”, по одному из двух названий Японии – Нихон, что переводится как “Страна восходящего солнца”.
114. Ряд11. Группа 4. Флеровий Fl. Атомная масса (289). Ранее носил имя “унунквадий” или “эка-свинец”.
Элемент 114 впервые был получен в Дубне, Россия в 2006 году. Официальное название “флеровий” дано в честь Лаборатории ядерных реакций им. Г.Н.Флерова Объединенного института ядерных исследований.
115. Ряд 11. Группа 5. Московий Mc. Атомная масса (290).
10 августа 2004 году получен 115-й элемент в Дубне, Россия * июня 2016 года ИЮПАК рекомендовал дать элементу название “московий” в честь Московской области, где находится Объединенный институт ядерных исследований (Дубна).
116. Ряд 11. Группа 6. Ливерморий Lv. Атомная масса (293). Более раннее название “унунгексий” или “эка-полоний”.
Ливерморий был открыт путем синтеза изотопов в 2000 году в Дубна, Россия. Официальное название дано в честь Ливерморской национальной лаборатории им. Э.Лоуренса, Ливермор, США.
117. Ряд 11. Группа 7. Теннессин Ts. Атомная масса (294).
Первооткрыватель: Объединенный институт ядерных исследований, Дубна, Россия. Открытие: 5 апреля 2010 года. Название дано в честь штата Теннесси, где находится лаборатория Ок-Ридж.
118. Ряд 11. Группа 8. Оганесон Og. Атомная масса . Временное название “унуноктий” или “эка-радон”.
Синтез ядер осуществлен в 2002 и 2005 годах в институте в Дубна. 28 ноября 2016 года дано название 118 элементу в честь академика Юрия Цолаковича Оганесяна.
119. Ряд 11. Группа 8. Унунений Uue. Он же “эка-франций”.
Неоткрытый химический элемент.
120. Ряд 11. Группа 8. Унбинилий Ubn. Он же “эка-радий”.
Неоткрытый химический элемент.